ホーム > 畜産 > 海外情報 > 2022年 > 米国食品医薬品局、培養鶏肉由来食品の事前協議プロセスを終了(米国)
米国食品医薬品局(FDA)は11月16日、カリフォルニア州に拠点を置くアップサイドフーズ(UPSIDE Foods)社が製造する培養鶏肉由来食品に関する市販前協議を終了したことを発表した。同協議は、FDAが2021年10月、同社による安全性評価の書類とデータを受理し開始したものであり、その後、22年3月、9月、11月に同社による追加・修正の書類とデータの提出を経て、今回の協議終了に至った。FDAは同協議において、現時点では安全性に関する疑問はないとしている。なお、市販前協議とはFDAが推奨する承認プロセス前に行う任意の安全性評価プロセスであり、食品製造・販売のための承認プロセスではない。今後、同社の培養鶏肉由来食品は、FDAによる連邦食品・医薬品・化粧品法に基づく食品安全規制要件順守の承認、米国農務省食品安全検査局(USDA/FSIS)による連邦食肉検査法(FMIA)および連邦家きん製品検査法(PPIA)に基づく食品安全・衛生要件順守の承認のプロセスを経る必要がある。
市販前協議の内容
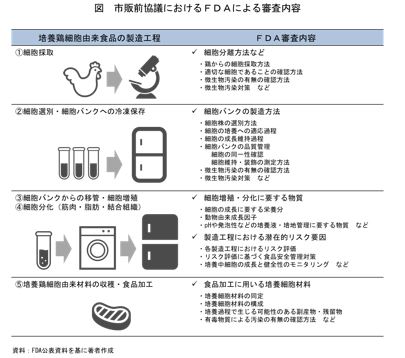
FDAによる市販前協議では、培養鶏肉由来食品の製造工程である(1)細胞採取、(2)細胞選別・細胞バンクへの冷凍保存、(3)細胞バンクからの移管・細胞増殖、(4)細胞分化(筋肉・脂肪・結合組織)、(5)培養鶏肉由来材料の回収・食品加工のそれぞれの段階における手段・方法、衛生対策、品質管理、リスク評価、安全性確保について、審査が行われた(図)。
代替食品業界からの声
代替タンパク質の技術革新を推進する米シンクタンクであるグッド・フード・研究所(GFI)は、FDAの発表を称賛する声明を公表した。培養動物細胞由来食品の商用化は、将来的な食肉需要増加に対応したタンパク質源の確保、水資源の保全・土壌健全性の確保、気候変動への対応、薬剤耐性リスクの低減などに貢献し、世界をより持続可能な食料システムへと移行するための有効な解決策であるとした。
今後の課題
一方で、カリフォルニア大学ロサンゼルス校(UCLA)メディカルセンターは、培養動物細胞由来食品の台頭は非常に難しい問題でもあるとしている。理論的には、タンパク質やビタミンB群を含む微量栄養素の供給源となるだけではなく、脂肪を多価不飽和脂肪酸に置き換えるなどして栄養分改善の加工が可能である。さらに抗生剤も不要となり、食中毒リスクも低減できるが、新しい産業であるだけに予期せぬ生物学的メカニズムが発生する可能性も否定できないとしている。
また、培養動物細胞由来食品の表示規制についても、21年9月、USDA/FSISが規制案策定に向けてパブリックコメントを実施したが(注)、現時点では未策定である。米国食肉業界からは「肉(meat)」という表記の禁止を求める声もある中で、今後の動向が注視される。
また、培養動物細胞由来食品の表示規制についても、21年9月、USDA/FSISが規制案策定に向けてパブリックコメントを実施したが(注)、現時点では未策定である。米国食肉業界からは「肉(meat)」という表記の禁止を求める声もある中で、今後の動向が注視される。
【調査情報部 令和4年12月7日発】
このページに掲載されている情報の発信元
農畜産業振興機構 調査情報部 (担当:調査情報部)
Tel:03-3583-9532
農畜産業振興機構 調査情報部 (担当:調査情報部)
Tel:03-3583-9532