ホーム > でん粉 > 調査報告 > でん粉利用に有用な新しい固体酸触媒
最終更新日:2011年9月9日
でん粉利用に有用な新しい固体酸触媒
2011年9月
東京工業大学 応用セラミックス研究所 原 亨和
硫酸は現代の化学工業に必要不可欠な触媒であるが、プロダクトとの分離、廃棄処理に多くのエネルギーを要する。酸をもつ固体材料「固体酸」はプロダクトとの分離にエネルギーをかける必要がなく、繰り返し使用できるため、環境負荷を極限まで低減した化学資源とエネルギーの生産を実現できるが、硫酸と同等の活性をもつ固体酸は開発されていなかった。このような背景の中、我々は全くあたらしいタイプの固体酸の開発に成功した。この固体酸はでん粉、セルロースといった安価で豊富な天然有機物を低温で部分的に炭化した後、硫酸・発煙硫酸でスルホ化するだけで得られる。この固体材料はエステル化、水和反応、加水分解反応で硫酸に匹敵、あるいはそれを上回る触媒活性を示し、繰り返し使用しても触媒活性は低下しない。
1.緒言
硫酸はさまざまな石油化学製品、化成品の原料、汎用薬品、医薬品の製造に必要不可欠な触媒である。しかし、硫酸は繰り返し使用できる触媒ではなく、中和などによる硫酸と製品の分離、廃酸処理に多くのエネルギーと労力が必要である。このため、年間1500万トン以上の硫酸が「リサイクルできない触媒」として消費され、膨大なエネルギーの浪費と廃棄物の排出が環境に大きな負荷を与えている。硫酸に依存する酸触媒反応プロセスをできるだけ環境に負荷を与えない高効率なプロセスに変えることは、今後の化学産業にとって大きな課題である。繰り返し使用でき、分離・回収が容易で毒性の少ない固体の酸―固体酸―はこの課題をクリアーする一つのキーワードである1、2)。
これまで、多種多様の無機酸化物系と高分子系の固体酸が開発され、その多くが工業的に使用されているが、化学資源の生産で硫酸代替触媒となる固体酸は(1)どのような環境でも機能する塩酸や硫酸のような強い酸点(ブレンステッド酸点)を多くもち、(2)熱的・化学的に安定な材料であり、(3)安価であることが求められる。シリカアルミナ、ゼオライト、含水ニオブ酸といった無機酸化物系の固体酸は、化学工業で必要不可欠な触媒であるが、一般的にその酸性水酸基に基づくブレンステッド酸点は水の存在下で充分に機能しない。工業的に重要な酸触媒反応の多くは水が関与するため、上記の無機酸化物系固体酸は汎用的な硫酸代替とはならない。一方、スルホン化ポリスチレン、ナフィオンといった強酸性高分子固体酸は水中でも酸として機能するスルホ基(SO3H)を高密度に有するが、その触媒活性は硫酸よりかなり低く、耐熱性も高くない。また、高価であるということもこれらの材料のユーティリィティーを制限している。このような現状で、我々は新しい概念の硫酸代替固体酸―高密度の安定なスルホ基をもつ炭素(カーボン)材料―の合成を試みた。
これまで、多種多様の無機酸化物系と高分子系の固体酸が開発され、その多くが工業的に使用されているが、化学資源の生産で硫酸代替触媒となる固体酸は(1)どのような環境でも機能する塩酸や硫酸のような強い酸点(ブレンステッド酸点)を多くもち、(2)熱的・化学的に安定な材料であり、(3)安価であることが求められる。シリカアルミナ、ゼオライト、含水ニオブ酸といった無機酸化物系の固体酸は、化学工業で必要不可欠な触媒であるが、一般的にその酸性水酸基に基づくブレンステッド酸点は水の存在下で充分に機能しない。工業的に重要な酸触媒反応の多くは水が関与するため、上記の無機酸化物系固体酸は汎用的な硫酸代替とはならない。一方、スルホン化ポリスチレン、ナフィオンといった強酸性高分子固体酸は水中でも酸として機能するスルホ基(SO3H)を高密度に有するが、その触媒活性は硫酸よりかなり低く、耐熱性も高くない。また、高価であるということもこれらの材料のユーティリィティーを制限している。このような現状で、我々は新しい概念の硫酸代替固体酸―高密度の安定なスルホ基をもつ炭素(カーボン)材料―の合成を試みた。
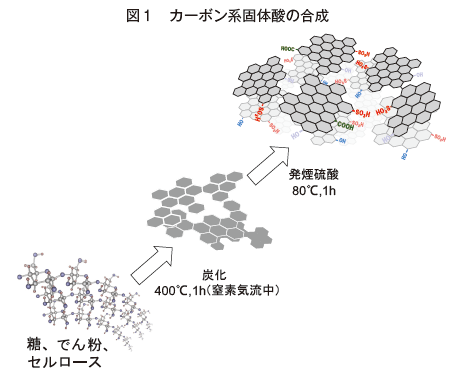
2.カ−ボン系固体酸の合成3-7)
芳香族炭化水素(トルエン、キシレンなどベンゼン環を含む炭化水素)は強酸性のスルホ基を容易に結合できる分子である。実際、ベンゼンスルホ酸、p−トルエンスルホ酸といった芳香族スルホ酸は比較的強い酸として機能するが、多くの溶媒に溶解するため、固体酸として使うことができない。一方、カーボン材料は熱的、化学的に安定な多環式芳香族炭化水素―ベンゼン環の集合体―と考えることができる。従って、高密度のスルホ基が結合したカーボン材料は不溶性の固体強酸として働く可能性がある。そこで、我々はこれまで機能性材料として使われることのなかった小さな炭素のシート(グラフェン)で構成された炭素材料、すなわち、有機化合物と不定形炭素材料(アモルファスカーボン)の中間状態なら安定なスルホ基を大量に保持する固体酸になると考えた3)。実際、目的のカーボン材料は図1に示すように、セルロース、でん粉などの安価で豊富な天然有機物を低温で部分的に炭化し、スルホ化するだけで簡単に得ることができる4-6)。この合成法では、300〜500℃での部分炭化によりフェノール性水酸基が結合した小さなグラフェンからなるアモルファスカーボンが形成される。このカーボン材料を硫酸中で加熱するとグラフェンのスルホ化と一部のフェノール性水酸基の酸化が進み、高密度のスルホ基、水酸基、カルボキシル基の結合したアモルファスカーボンが生成する。後述のように、これら全ての官能基が反応で重要な役割を果たす。
3.カーボン系固体酸の触媒能
親水的基質に疎水的スルホ基が結合したカーボン系固体酸は低級・高級脂肪酸のエステル化4、5)、エチレンなどのアルケンの水和によるアルコール生成5)、加水分解反応6)といった水存在下での酸触媒反応に硫酸に匹敵する触媒能をもつ硫酸代替固体酸触媒として機能する。反応後、カーボン固体酸は液相と容易に分離し、分離した固体酸は繰り返し・連続的に反応に利用できる。ここではカーボン系固体酸によるセルロースやでん粉の加水分解反応を解説する。
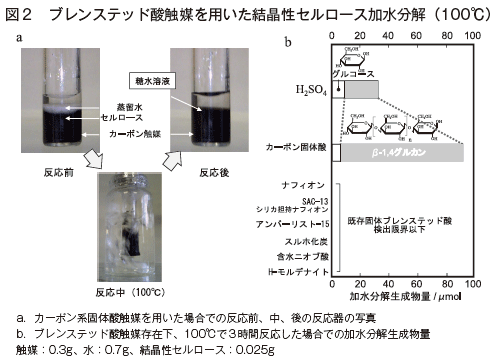
図2aに反応前後のリアクターの写真、図2bには同一の反応条件(触媒量:0.3g、水:0.7g、セルロース(結晶性セルロースAvicel):0.025g、反応温度:100℃、反応時間:3時間)における種々のブレンステッド酸触媒のセルロース加水分解能を示す。図2aはカーボン系固体酸を触媒とした場合、反応後に白色のセルロースが消失し、透明の溶液が得られることを示している。この溶液にはセルロースの加水分解生成物であるグルコースとβ-1,4グルカン(4〜12個のグルコースがβ-1,4グルコシド結合で結合した直鎖状高分子)が溶解していることが確認された6)。このことから、カーボン系固体酸は鉱酸触媒硫酸と同様なメカニズム((1)β-1,4グルカン間の水素結合の切断とβ-1,4グルカンの加水分解による水溶性β-1,4グルカンの生成、(2)水溶性β-1,4グルカンの加水分解による単糖の生成)でセルロースを加水分解していると考えられる。図2bはカーボン系固体酸がセルロースをグルコースと水溶性β-1,4グルカンに加水分解し、その加水分解能は硫酸に匹敵することを示している。リアクタントの結晶性セルロースは全て反応開始後6時間以内に水溶性の糖に加水分解され、系内から消失する。反応後、カーボン材料は沈殿により速やかに糖水溶液から分離する。分離したカーボン材料を洗浄・乾燥し、25回以上反応を繰り返しても加水分解触媒能に変化はみられなかった6)。前述のようにグラフェンに結合したカルボキシル基がこの触媒能の安定性に大きく貢献している。このようにカーボン系固体酸が高い触媒能を示す一方、既存の無機酸化物および高分子固体酸はセルロースを加水分解しない6)。図2bの反応条件ではグルコース生成が水溶性β-1,4グルカンの生成を大きく下回ることから、この条件でカーボン系固体酸はβ-1,4グルカンの加水分解によるグルコース生成を効率的に進めることができないが、リアクタントのセルロース量を増やし、水の量を減少させるとセルロースの加水分解は飛躍的に促進される6)。図3には図2aで示したリアクターと異なるリアクターでセルロースをカーボン系固体酸で加水分解した結果を示す。この条件ではグルコース生成がβ-1,4グルカンを上回り、グルコース生成速度は図2におけるそれの数十倍に達する。なお、図3と同じ反応条件における硫酸の触媒能はカーボン系固体酸の8割程度である。さらにカーボン系固体酸は結晶性セルロースだけでなく、ユーカリや藁などの天然セルロース原料も硫酸と同等の触媒能で単糖類に加水分解できるだけでなく、硫酸より早くでん粉をグルコースに加水分解できることが確認されている7)。同一の反応条件(触媒量:0.3g、水:0.5g、コーンスターチ:0.3g、反応温度:100℃、反応時間:3時間)で、カーボン系固体酸のコーンスターチからのグルコース生成は硫酸の約2倍である。
図2aに反応前後のリアクターの写真、図2bには同一の反応条件(触媒量:0.3g、水:0.7g、セルロース(結晶性セルロースAvicel):0.025g、反応温度:100℃、反応時間:3時間)における種々のブレンステッド酸触媒のセルロース加水分解能を示す。図2aはカーボン系固体酸を触媒とした場合、反応後に白色のセルロースが消失し、透明の溶液が得られることを示している。この溶液にはセルロースの加水分解生成物であるグルコースとβ-1,4グルカン(4〜12個のグルコースがβ-1,4グルコシド結合で結合した直鎖状高分子)が溶解していることが確認された6)。このことから、カーボン系固体酸は鉱酸触媒硫酸と同様なメカニズム((1)β-1,4グルカン間の水素結合の切断とβ-1,4グルカンの加水分解による水溶性β-1,4グルカンの生成、(2)水溶性β-1,4グルカンの加水分解による単糖の生成)でセルロースを加水分解していると考えられる。図2bはカーボン系固体酸がセルロースをグルコースと水溶性β-1,4グルカンに加水分解し、その加水分解能は硫酸に匹敵することを示している。リアクタントの結晶性セルロースは全て反応開始後6時間以内に水溶性の糖に加水分解され、系内から消失する。反応後、カーボン材料は沈殿により速やかに糖水溶液から分離する。分離したカーボン材料を洗浄・乾燥し、25回以上反応を繰り返しても加水分解触媒能に変化はみられなかった6)。前述のようにグラフェンに結合したカルボキシル基がこの触媒能の安定性に大きく貢献している。このようにカーボン系固体酸が高い触媒能を示す一方、既存の無機酸化物および高分子固体酸はセルロースを加水分解しない6)。図2bの反応条件ではグルコース生成が水溶性β-1,4グルカンの生成を大きく下回ることから、この条件でカーボン系固体酸はβ-1,4グルカンの加水分解によるグルコース生成を効率的に進めることができないが、リアクタントのセルロース量を増やし、水の量を減少させるとセルロースの加水分解は飛躍的に促進される6)。図3には図2aで示したリアクターと異なるリアクターでセルロースをカーボン系固体酸で加水分解した結果を示す。この条件ではグルコース生成がβ-1,4グルカンを上回り、グルコース生成速度は図2におけるそれの数十倍に達する。なお、図3と同じ反応条件における硫酸の触媒能はカーボン系固体酸の8割程度である。さらにカーボン系固体酸は結晶性セルロースだけでなく、ユーカリや藁などの天然セルロース原料も硫酸と同等の触媒能で単糖類に加水分解できるだけでなく、硫酸より早くでん粉をグルコースに加水分解できることが確認されている7)。同一の反応条件(触媒量:0.3g、水:0.5g、コーンスターチ:0.3g、反応温度:100℃、反応時間:3時間)で、カーボン系固体酸のコーンスターチからのグルコース生成は硫酸の約2倍である。

4.おわりに
我々は民間企業との共同研究により、上記の触媒を利用した新しいタイプの植物性バイオマスの糖化プロセスの構築に成功している。このプロセスの大きな特長は(1)セルロースバイオマスの種類によらず短時間で高いグルコース収率を達成し、(2)高いエネルギー収支(上記単独プラントのグルコース製造のエネルギー収支:1.7〜2.3)を実現するだけでなく、(3)グルコースの過分解物が副生しないことにある。これらの特長は硫酸を上回る加水分解触媒能を有し、反応条件を適切に設定することで長期間高い活性を維持でき、特異な構造を有するカーボン系固体酸触媒よって発現する。また、プロセス自体に由来する特長としては(4)単純かつ大規模化が容易で、(5)セルロース系と事故米、食品残渣、残飯等の非可食でん粉系の双方のバイオマスを原料にでき、(6)グルコースと他の単糖を分離して生産できることが挙げられる。現時点でこのプロセスは実証段階にあり、大規模展開のために触媒の量産計画が進んでいる。
文 献
1)M.Misono,Comptes Rendus de l’Academie des Sciences, Serie IIc: Chimie 3, 471(2000).
2)T. Okuhara, Chem. Rev. 102, 3641(2002).
3)M. Hara,T. Yoshida, A. Takagaki, T. Takata, J. N. Kondo, K. Domen, S. Hayashi, Angew. Chem. Int. Ed. , 43, 2955(2004).
4)M. Toda, A. Takagaki, M. Okamura, J. N. Kondo, K. Domen, S. Hatashi, M. Hara, Nature, 438, 178(2005).
5)M. Okamura, A. Takagaki, M. Toda, J. N. Kondo, K. Domen, S. Hatashi, M. Hara, Chemistry of Materials, 18, 3039(2006).
6)S. Suganuma, K. Nakajima, M. Kitano, D. Yamaguchi, H. Kato, S. Hayashi, M. Hara, J. Am. Chem. Soc. 130,12787(2008).
7)D. Yamaguchi, M. Hara, Solid State Sci. , 12, 1018(2010).
2)T. Okuhara, Chem. Rev. 102, 3641(2002).
3)M. Hara,T. Yoshida, A. Takagaki, T. Takata, J. N. Kondo, K. Domen, S. Hayashi, Angew. Chem. Int. Ed. , 43, 2955(2004).
4)M. Toda, A. Takagaki, M. Okamura, J. N. Kondo, K. Domen, S. Hatashi, M. Hara, Nature, 438, 178(2005).
5)M. Okamura, A. Takagaki, M. Toda, J. N. Kondo, K. Domen, S. Hatashi, M. Hara, Chemistry of Materials, 18, 3039(2006).
6)S. Suganuma, K. Nakajima, M. Kitano, D. Yamaguchi, H. Kato, S. Hayashi, M. Hara, J. Am. Chem. Soc. 130,12787(2008).
7)D. Yamaguchi, M. Hara, Solid State Sci. , 12, 1018(2010).
このページに掲載されている情報の発信元
農畜産業振興機構 調査情報部 (担当:企画情報グループ)
Tel:03-3583-8678
農畜産業振興機構 調査情報部 (担当:企画情報グループ)
Tel:03-3583-8678