ホーム > でん粉 > 調査報告 > サツマイモに甚大な被害を与える侵入病害「基腐病」の超高感度・簡易・迅速診断
最終更新日:2019年10月10日
サツマイモに甚大な被害を与える侵入病害「基腐病」の超高感度・簡易・迅速診断
2019年10月
東京大学 大学院農学生命科学研究科
助教 前島 健作、教授 山次 康幸
助教 前島 健作、教授 山次 康幸
【要約】
2018年に沖縄県、鹿児島県、宮崎県においてサツマイモ(かんしょ)の侵入病害「基腐病」の発生が初めて確認された。本病は土壌中および貯蔵中の塊根を腐敗させ生産上甚大な被害を与えるが、診断技術が未確立だったため発生圃場の特定や健全苗の確保が困難だった。東京大学植物病院®では、これまで数週間かかっていた本病の診断を30分程度に短縮する遺伝子診断技術を世界で初めて開発した。今回はこの診断技術について、本病の性状とともに紹介したい。
はじめに
サツマイモ(以下「かんしょ」という)は生産性の高い重要作物として日本各地で栽培され、食用の他でん粉原料や焼酎原料としても利用されている。また、国の食料安全保障面でも緊急時のカロリー供給源に位置付けられている1)。鹿児島県、宮崎県、沖縄県はかんしょの主要産地として国内の栽培面積および生産量の約5割を占めるが、2018年11月以降、これまで国内未発生だった基腐病(仮称)の発生が相次いで確認され大きな問題となった。本病は糸状菌(Plenodomus destruens)の感染により引き起こされるが、生産現場では症状の紛らわしい他の植物病も発生していて混同されやすい上、診断方法が確立されていなかったため、簡便かつ迅速で信頼性の高い診断技術が求められていた。東京大学植物病院®では、2019年3月に本病の遺伝子診断技術を世界で初めて開発した。本稿ではその診断技術を中心に解説する。
なお、本病の和名はまだ正式に決定されていないが、「サツマイモ基腐病」が提案されているため2)、本稿では病名および病原体名をそれぞれ基腐病および基腐病菌と表記する。
なお、本病の和名はまだ正式に決定されていないが、「サツマイモ基腐病」が提案されているため2)、本稿では病名および病原体名をそれぞれ基腐病および基腐病菌と表記する。
1.発生状況
基腐病(英名:foot rot disease)は、およそ100年前に米国で発見され3)、これまで南北アメリカやアフリカ、ニュージーランドなどで被害が知られていた4)。しかし、この10年の間に台湾、中国、日本、韓国で相次いで発生し、各地で大きな被害を引き起こしている5)〜8)。国内では2018年11月末に沖縄県で初発生が報告され7)、その後、鹿児島県(同年12月)9)および宮崎県(2019年1月)10)で発生が報告された。各県の広い範囲で発生し、激発圃場では大幅な減収となり、でん粉や焼酎の生産にも影響を及ぼしている。今年も苗床や本圃において発生が確認されている状況にある。
2.伝染環および症状
基腐病菌Plenodomus destruens(別名Phomopsis destruens)は糸状菌(カビ)の一種で、ヒルガオ科植物に感染するが、農業上問題となる宿主はかんしょだけである。基腐病菌の伝染はかんしょの育苗、本圃栽培、貯蔵の各ステップで起きる。まず苗床において感染した種芋から苗へと感染する。感染苗が圃場に植えられると、茎の地際部に形成される分生子殻から分生子(胞子)が飛散し周囲に感染を拡大する。基腐病菌は茎を通じて塊根にも侵入し感染する。貯蔵中の塊根でも感染と表面の分生子殻形成が進行し伝染源となる。また土壌中でも植物残渣上で越冬できるため伝染源となる11)〜13)。
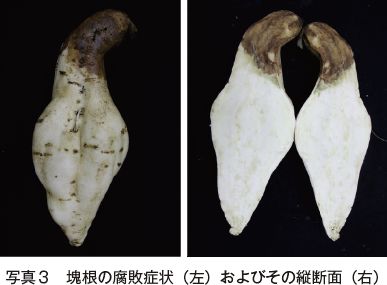
基腐病に感染したかんしょは生育不良になり、植物全体が萎凋、枯死する激しい症状を示す(写真1)。茎は地際部が褐色〜黒色に腐敗し、表面に多数の分生子殻が形成される(写真2)。葉は感染を受けないものの、黄化や落葉が生じる。地上部が早期に枯死した場合は塊根が形成されず収穫皆無となり、収穫期まで生き残った場合でも土壌中の塊根がしょ梗(なり口)側から腐敗する(写真3)。腐敗部分は褐色で柔らかく多量の水分を含んだスポンジ状を呈し、水分が抜けると収縮して固くなる。感染した塊根は収穫時に症状がない場合でも貯蔵中に腐敗して問題となる11)13)14)。
基腐病に感染したかんしょは生育不良になり、植物全体が萎凋、枯死する激しい症状を示す(写真1)。茎は地際部が褐色〜黒色に腐敗し、表面に多数の分生子殻が形成される(写真2)。葉は感染を受けないものの、黄化や落葉が生じる。地上部が早期に枯死した場合は塊根が形成されず収穫皆無となり、収穫期まで生き残った場合でも土壌中の塊根がしょ梗(なり口)側から腐敗する(写真3)。腐敗部分は褐色で柔らかく多量の水分を含んだスポンジ状を呈し、水分が抜けると収縮して固くなる。感染した塊根は収穫時に症状がない場合でも貯蔵中に腐敗して問題となる11)13)14)。


3.診断技術の開発
基腐病の防除に最も重要とされるのは、健全苗の利用である。そのためには発生圃場および感染種芋の特定が必要だが、現地では既知の塊根腐敗性あるいは立枯性の病害(乾腐病、つる割病、茎根腐細菌病)も発生しており15)、症状だけで基腐病か否かを判別することが困難である。基腐病の診断には、培地を用いた分離培養が用いられる。しかし、基腐病菌は培地上での成長が遅いため、診断には2週間程度かかる上、雑菌が培地上で優占してしまい感染植物の6割以上を見逃してしまう事例も報告されている16)。また近年報告されたPCRによる遺伝子診断技術では16)、遺伝的に近縁な関係にある基腐病菌と乾腐病菌を見分けることができないという問題があった。
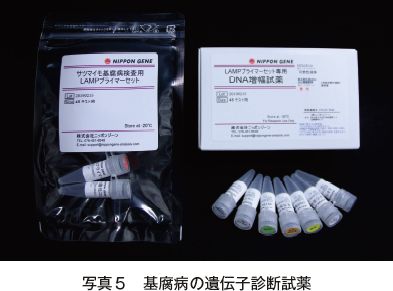
東京大学植物病院®では生産現場からの診断技術開発の依頼を受けて、簡易・迅速・高感度で標的特異性の高い遺伝子増幅法であるLAMP(Loop-mediated isothermal amplification;ループ介在等温増幅)を利用した、基腐病の遺伝子診断技術を確立した(写真4)。これは基腐病を対象とする唯一の遺伝子診断技術であり、前述の培地やPCRによる方法と比べて迅速性(DNA抽出から判定まで約30分で終了)、簡易性(高度な技術や高価な機器が不要。目視で判定可能)、検出感度(PCRと比べて100倍)、正確性(基腐病菌と乾腐病菌を区別可能)に優れる。本診断技術を用いた試薬は株式会社ニッポンジーン マテリアル(https://www.nippongenematerial.com)により受注生産されている(写真5)。
東京大学植物病院®では生産現場からの診断技術開発の依頼を受けて、簡易・迅速・高感度で標的特異性の高い遺伝子増幅法であるLAMP(Loop-mediated isothermal amplification;ループ介在等温増幅)を利用した、基腐病の遺伝子診断技術を確立した(写真4)。これは基腐病を対象とする唯一の遺伝子診断技術であり、前述の培地やPCRによる方法と比べて迅速性(DNA抽出から判定まで約30分で終了)、簡易性(高度な技術や高価な機器が不要。目視で判定可能)、検出感度(PCRと比べて100倍)、正確性(基腐病菌と乾腐病菌を区別可能)に優れる。本診断技術を用いた試薬は株式会社ニッポンジーン マテリアル(https://www.nippongenematerial.com)により受注生産されている(写真5)。

4.診断技術の活用
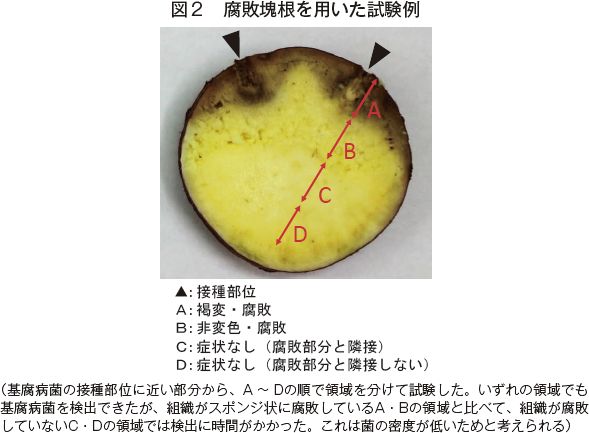
本診断技術は、(1)簡易DNA抽出16)と(2)LAMPによる遺伝子増幅の2ステップからなる(図1)。基腐病菌を接種した塊根を用いて試験したところ、腐敗部分に加えて、まだ腐敗していない部分からも菌の検出が可能であった(図2)。この結果は、塊根の健全性を発病前の段階で遺伝子診断できることを示している。ただし、正確な診断にはなるべく病原菌が高密度に存在する組織をサンプリングすることが重要である。最適なサンプリング部位についてはまだ現地での検証段階だが、現在のところ、次のようにサンプリングすることを推奨している。
・腐敗した塊根:腐敗して柔らかくなっている部分
・腐敗していない塊根:なり口の部分
・茎:地際部分。特に黒色〜黒褐色の変色や分生子殻の形成が認められる場合はその部分
本診断技術により、発生圃場や感染種芋の特定を通じて健全苗の確保が容易となり、基腐病に対し的確な予防措置をとることができると考えられる。また、栽培期間中も早期診断による防除が可能になる。基腐病は東アジア地域を含む世界各地で発生しているため、海外においてもこの診断技術が役立つことが期待される。
・腐敗した塊根:腐敗して柔らかくなっている部分
・腐敗していない塊根:なり口の部分
・茎:地際部分。特に黒色〜黒褐色の変色や分生子殻の形成が認められる場合はその部分
本診断技術により、発生圃場や感染種芋の特定を通じて健全苗の確保が容易となり、基腐病に対し的確な予防措置をとることができると考えられる。また、栽培期間中も早期診断による防除が可能になる。基腐病は東アジア地域を含む世界各地で発生しているため、海外においてもこの診断技術が役立つことが期待される。

おわりに
基腐病の防除対策については、既に各県において公表されている通りであり7)9)10)、現地での発生実態の解明や農薬登録に向けた研究も進められている15)。これら防除技術が本診断技術とともに普及することで、発生を未然に抑止し、発生範囲を縮小させるなど、基腐病の早期解決につながると考えられる。一方で、基腐病の全国的な発生の有無や、他の類似病害が基腐病の発生に与える影響の解明なども関心が持たれるところであり、今後の研究の展開が待たれる。
【参考文献】
1)農林水産省(2015)「緊急事態食料安全保障指針」〈http://www.maff.go.jp/j/zyukyu/anpo/shishin.html〉(2019/09/17アクセス)
2)前田藍、河村太、河野伸二、大城篤、岡田吉弘(2019)「我国におけるPhomopsis destruensによるサツマイモ基腐病(新称)の発生」『九州病害虫研究会 第97回研究発表会』病09(講要)
3)Harter, L.L.(1913)「Foot rot, a new disease of the sweet potato」『Phytopathology』(3)pp.243–245.
4)Liu, Q.,Liu, J.,Zhang, P.,He, S.(2014)「Root and tuber crops」『Encyclopedia of agriculture and food systems』pp.46–61. Elsevier, Amsterdam.
5)Huang, C.W.,Chuang, M.F.,Tzean, S.S.,Yang, H.R.,Ni, H.F.(2012)「Occurrence of foot rot disease of sweet potato caused by Phomopsis destruens in Taiwan」『Plant Pathol. Bull.』(21)pp.47–52.
6)Gai, Y.,Ma, H.,Chen, X.,Zheng, J.,Chen, H.,Li, H.(2016)「Stem blight, foot rot and storage tuber rot of sweet potato caused by Plenodomus destruens in China」『J. Gen. Plant Pathol.』(82)pp.181–185.
7)沖縄県病害虫防除技術センター(2018)「平成30年度病害虫発生予察特殊報第8号」〈https://www.pref.okinawa.jp/site/norin/byogaichubojo/documents/h30_12_tokusyu8.pdf〉(2019/09/17アクセス)
8)Paul, N.C.,Nam, S.-S.,Park, W.,Yang, J.-W.,Kachroo, A.(2019)「First report of storage tuber rot in sweetpotato (Ipomoea batatas) caused by Plenodomus destruens in Korea」『Plant Dis.』(103)p.1020.
9)鹿児島県病害虫防除所(2018)「平成30年度病害虫発生予察特殊報第3号」〈http://www.jppn.ne.jp/kagoshima/yosatu/tokusyuhou/2018/TokuNo3.pdf〉 (2019/09/17アクセス)
10)宮崎県病害虫防除・肥料検査センター(2019)「平成30年度病害虫発生予察特殊報第4号」〈http://www.jppn.ne.jp/miyazaki/10/tokusyu/30nen/h30tokusyu04.pdf〉 (2019/09/17アクセス)
11)Harter, L.L.,Weimer, J.L.(1929)「A monographic study of sweet-potato diseases and their control」『US Dep. Agric. Tech. Bull.』(99)pp.27–30.
12)Lopes, C.A.,Silva, J.B.C.(1993)「Management measures to control foot rot of sweet potato caused by Plenodomus destruens」『Int. J. Pest Manag.』(39)pp.72–74.
13)Ames, T.,Smit, N.E.J.M.,Braun, A.R.,O’Sullivan, J.N.,Skoglund, L.G.(1997)「Storage root and postharvest diseases」『Sweetpotato: major pests, diseases, and nutritional disorders』 pp.96–97. International Potato Center, Lima, Peru.
14)Harter, L.L.,Weimer, J.L.,Adams, J.M.R.(1918)「Sweet-potato storage-rots」『J. Agric. Res.』(15)pp.337–368.
15)小林有紀(2019)「サツマイモ基腐病(仮称)の発生と対策」『植物防疫』(73)pp.501–505.
16)Lin, C.-Y.,Huang, C.-W.,Yang, H.-R.,Lai, S.-Y.,Ni, H.-F.(2017)「A method for the specific detection of Phomopsis destruens in sweet potato by PCR」『J. Taiwan Agric. Res.』(66)pp.276–285.
1)農林水産省(2015)「緊急事態食料安全保障指針」〈http://www.maff.go.jp/j/zyukyu/anpo/shishin.html〉(2019/09/17アクセス)
2)前田藍、河村太、河野伸二、大城篤、岡田吉弘(2019)「我国におけるPhomopsis destruensによるサツマイモ基腐病(新称)の発生」『九州病害虫研究会 第97回研究発表会』病09(講要)
3)Harter, L.L.(1913)「Foot rot, a new disease of the sweet potato」『Phytopathology』(3)pp.243–245.
4)Liu, Q.,Liu, J.,Zhang, P.,He, S.(2014)「Root and tuber crops」『Encyclopedia of agriculture and food systems』pp.46–61. Elsevier, Amsterdam.
5)Huang, C.W.,Chuang, M.F.,Tzean, S.S.,Yang, H.R.,Ni, H.F.(2012)「Occurrence of foot rot disease of sweet potato caused by Phomopsis destruens in Taiwan」『Plant Pathol. Bull.』(21)pp.47–52.
6)Gai, Y.,Ma, H.,Chen, X.,Zheng, J.,Chen, H.,Li, H.(2016)「Stem blight, foot rot and storage tuber rot of sweet potato caused by Plenodomus destruens in China」『J. Gen. Plant Pathol.』(82)pp.181–185.
7)沖縄県病害虫防除技術センター(2018)「平成30年度病害虫発生予察特殊報第8号」〈https://www.pref.okinawa.jp/site/norin/byogaichubojo/documents/h30_12_tokusyu8.pdf〉(2019/09/17アクセス)
8)Paul, N.C.,Nam, S.-S.,Park, W.,Yang, J.-W.,Kachroo, A.(2019)「First report of storage tuber rot in sweetpotato (Ipomoea batatas) caused by Plenodomus destruens in Korea」『Plant Dis.』(103)p.1020.
9)鹿児島県病害虫防除所(2018)「平成30年度病害虫発生予察特殊報第3号」〈http://www.jppn.ne.jp/kagoshima/yosatu/tokusyuhou/2018/TokuNo3.pdf〉 (2019/09/17アクセス)
10)宮崎県病害虫防除・肥料検査センター(2019)「平成30年度病害虫発生予察特殊報第4号」〈http://www.jppn.ne.jp/miyazaki/10/tokusyu/30nen/h30tokusyu04.pdf〉 (2019/09/17アクセス)
11)Harter, L.L.,Weimer, J.L.(1929)「A monographic study of sweet-potato diseases and their control」『US Dep. Agric. Tech. Bull.』(99)pp.27–30.
12)Lopes, C.A.,Silva, J.B.C.(1993)「Management measures to control foot rot of sweet potato caused by Plenodomus destruens」『Int. J. Pest Manag.』(39)pp.72–74.
13)Ames, T.,Smit, N.E.J.M.,Braun, A.R.,O’Sullivan, J.N.,Skoglund, L.G.(1997)「Storage root and postharvest diseases」『Sweetpotato: major pests, diseases, and nutritional disorders』 pp.96–97. International Potato Center, Lima, Peru.
14)Harter, L.L.,Weimer, J.L.,Adams, J.M.R.(1918)「Sweet-potato storage-rots」『J. Agric. Res.』(15)pp.337–368.
15)小林有紀(2019)「サツマイモ基腐病(仮称)の発生と対策」『植物防疫』(73)pp.501–505.
16)Lin, C.-Y.,Huang, C.-W.,Yang, H.-R.,Lai, S.-Y.,Ni, H.-F.(2017)「A method for the specific detection of Phomopsis destruens in sweet potato by PCR」『J. Taiwan Agric. Res.』(66)pp.276–285.
このページに掲載されている情報の発信元
農畜産業振興機構 調査情報部 (担当:企画情報グループ)
Tel:03-3583-8678
農畜産業振興機構 調査情報部 (担当:企画情報グループ)
Tel:03-3583-8678