ホーム > でん粉 > 調査報告 > サツマイモ基腐病の発生と防除の取り組み
最終更新日:2021年10月11日
サツマイモ基腐病の発生と防除の取り組み
2021年10月
国立研究開発法人農業・食品産業技術総合研究機構 九州沖縄農業研究センター
暖地畑作物野菜研究領域 畑作物・野菜栽培グループ 上級研究員 小林 有紀
暖地畑作物野菜研究領域 畑作物・野菜栽培グループ 上級研究員 小林 有紀
【要約】
サツマイモ基腐病が急速に全国に広がっている。基腐病対策の基本は「持ち込まない、増やさない、残さない」の三つである。最も重要なことは、無病健全苗を生産または確保し、圃場に植え付けることである。発生が認められた圃場では、生育初期の発病株の抜き取りと予防的な薬剤散布、排水対策、早期収穫、罹病残渣の持ち出しと分解促進、土壌消毒、抵抗性品種の利用またはかんしょ以外の作物との輪作、休耕などの対策を総合的に実施する必要がある。
1.国内での発生状況
2018年秋から、鹿児島県および宮崎県において、かんしょの株が立ち枯れ、塊根(イモ)が腐敗する症状が多発し、収量の減少が深刻な問題となっている。沖縄県のかんしょ産地でも同様の症状が認められており、これら3県では、国内ではこれまで発生報告のなかったサツマイモ基腐病(以下「基腐病」という)が発生していたことが明らかになった。本病は、2020〜21年秋冬には熊本県、福岡県、長崎県、高知県、静岡県、岐阜県、2021年夏以降には群馬県、茨城県、東京都、千葉県、岩手県、愛媛県、福井県、埼玉県、山形県、石川県、北海道でも発生が確認されており(2021年8月31日現在)、急速に全国に広がっている。広域的な感染拡大は、主に基腐病菌に感染した種苗の移動により生じる可能性が考えられる。
2.発生生態
基腐病は、Diaporthe destruens(ディアポルテ・デストルエンス)という糸状菌に感染することにより、苗床や本圃で発生する。貯蔵中の塊根にも発生する。基腐病菌は、主に、感染した種イモや苗を植え付けることで圃場に持ち込まれる。圃場で生育不良や萎れ、黄変、赤変などした株の地際のあたりが暗褐色〜黒色になっていたら基腐病の可能性がある(図1A、B)。本病の病変部には柄子殻または分生子殻とも呼ばれる微小な黒粒が多数形成され(図1C)、水に濡れるなどすると、そこからおびただしい数の胞子が漏出する(図1D)。これらの胞子は、降雨により生じる停滞水や跳ね上がりなどにより周辺株に広がり、基腐病のまん延を引き起こす。株元以外の茎でも、畝間の汚染土壌や周辺株の病変部、水で移動した胞子などに接触すると感染し、発病すると考えられる。本圃で茎葉が繁茂する生育旺盛期は、株の異常に気付きにくいため、発病が密かに進行する。そのため、収穫期が近づき茎葉の生育が衰える秋頃になって一気に枯れ上がったように見えることが多い(図1E)。株の地際が感染すると、地下部の茎、しょ梗(茎と塊根をつなぐ部分)、塊根へと病徴が進展するため、塊根はなり首側から褐色〜暗褐色に腐敗することが多い(図1F)。また、収穫時には健全に見えた塊根が貯蔵中に発病し、腐敗することもある。収穫後は、圃場の罹病残渣中で病原菌が生き残り、次作の伝染源となる。発病株が少ないと、基腐病の発生に気付かないまま栽培を繰り返し、種苗や圃場の土壌の汚染が急速に高まる可能性がある。そのため、1年目はわずかな発病であったとしても、何も対策をとらずにいると、数年後には激発して収穫皆無となる恐れもある。

3.類似病害との識別
南九州では、かんしょに立枯・塊根腐敗症状が発生した圃場において、基腐病の他、乾腐病、茎根腐細菌病、つる割病の発生を確認している1)。
(1)基腐病
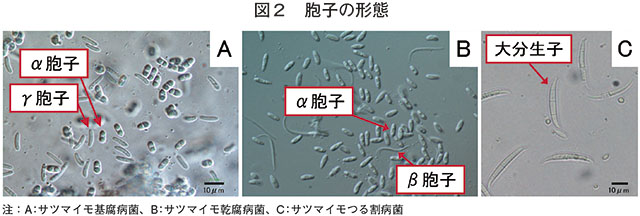
基腐病は、株元が変色し、落葉して萎凋、枯死し、塊根は主になり首側からやや硬く腐敗するのが特徴である。茎や塊根などの病変部に形成される柄子殻を生物顕微鏡で観察すると、柄子殻から噴き出すおびただしい数の胞子が確認できる。基腐病菌は、形態の異なるα(アルファ)胞子とγ(ガンマ)胞子を形成する(図2A)。
(2)乾腐病
乾腐病は、基腐病菌と近縁の糸状菌であるDiaporthe batatas(ディアポルテ・バタタス)に感染することにより発生する。主に貯蔵中の塊根が腐敗するが、乾腐病菌に感染した種イモを苗床に伏せ込むと、萌芽苗に基腐病と類似した症状が生じることがある2)。また、収穫期頃のかんしょの茎および塊根においても乾腐病の発生が確認されているが1)、乾腐病菌は基腐病菌に比べ病原性が弱く3)、本圃では老化した茎が乾腐病菌に感染した可能性が考えられる2)。乾腐病の症状は基腐病と類似しており(図3)、病徴から両者を識別するのは難しい。乾腐病菌も罹病部位に柄子殻を形成し、その中に基腐病菌と類似したα胞子を形成するが、その胞子は基腐病菌よりも細く、端が尖った印象がある(図2B)。また、α胞子の他にβ(ベータ)胞子を形成する。両病原菌とも2種類の胞子が常に観察できるとは限らないが、γまたはβ胞子を観察できた場合には、どちらの病害か判断できる。なお、基腐病菌と乾腐病菌を特異的に検出し、両病害を診断可能なリアルタイムPCR法が開発されている4)。

(3)茎根腐細菌病
茎根腐細菌病は、細菌であるDickeya sp.(ディケヤ属の一種)に感染することにより発生する。茎や葉柄が基腐病よりも軟らかく腐敗し(図4左)、時折、株全体が萎凋、枯死する。塊根も軟らかく腐敗し、健全部との境界が黒褐色になるのが特徴であるが(図4右)、境界が変色しない場合もある5)。

(4)つる割病
つる割病は、主に、糸状菌であるFusarium oxysporum f.sp. batatas(フザリウム・オキシスポラム分化型バタタス)に感染することにより発生する。茎が縦に裂けて繊維が目立つのが特徴であるが(図5A〜C)、裂けずに黒褐色に腐ることもある。白い粉が吹いたような病変部を生物顕微鏡で観察すると、フザリウム属菌の大分生子が確認できる(図2C)。塊根は基腐病のように腐敗はせず無病徴感染するが、外観が健全に見えても内部の導管が褐変していたり(図5E)、なり首側が裂けて繊維状になったりすることもある(図5D)。

4.防除対策
未発生地域では汚染種苗を「持ち込まない」ことが最も重要な防除対策となる。また、初発生地域では基腐病菌を定着させないための対策が必要となる。病原菌による土壌の汚染が進んでからの防除は難しくなるため、早期に発見し、少発生のうちに徹底的に「増やさない」「残さない」対策を実施して封じこめることが望ましい。常発生地域では健全種苗の供給・確保や、圃場の病原菌密度を低減させるための対策が必要となる。
(1)「持ち込まない」対策
感染苗による病原菌の本圃への持ち込みを防ぐため、(ア)種イモ採取用の専用圃場を設置して管理する(イ)定期的にウイルスフリー苗やバイオ苗を導入して種苗を更新する(ウ)苗床消毒(エ)種苗の選別・消毒を行う―などして、無病健全苗を生産することが必須である。
基腐病が発生した圃場から採取した塊根は、収穫時に健全に見えても、貯蔵中や翌年苗床に伏せ込んだ後に発病する可能性があるため、種イモは必ず未発生圃場から採取し、選別と消毒をした後に健全な苗床に伏せ込む。ウイルスフリー苗やバイオ苗を利用して育苗する場合も、苗が病原菌に感染している可能性は皆無ではないため、必ず苗消毒を行ってから健全な苗床に挿苗する。
苗床では、生育や葉色に異常のある株を見つけたら種イモごと速やかに苗床の外に持ち出し、適切に処分する。株元が変色していない萌芽苗でも基腐病菌を保菌している可能性があるため、苗は地際から5センチメートル以上離れた部分で採取し、当日調製したベノミル水和剤またはチウラム・ベノミル水和剤を用いて採苗と同時に消毒を行うことで発病リスクを低下できる。保菌苗を切ったハサミで健全苗を切ると、健全苗が病原菌に感染する恐れがあるため、採苗時のハサミはこまめに火炎滅菌または丁寧な水洗と拭き取りなどを行い、健全苗への病原菌の伝染を予防する。
なお、本圃へ定植する苗を購入する際には、(ア)適切な方法で生産された無病健全苗であること(イ)変色などの異常がないこと―を確認し、未消毒の苗であれば消毒してから本圃に定植する。
苗床で基腐病が発生した場合は、苗床から種イモを含め残渣を極力持ち出した上で、夏場に複数回耕うんし、残渣の分解を促進する。苗床の土壌消毒は、ダゾメット粉粒剤を用いて、地温、土壌水分など適切な条件下で実施する。土壌消毒効果を高めるため、薬剤処理後直ちにビニールなどで被覆する。
基腐病が発生した圃場から採取した塊根は、収穫時に健全に見えても、貯蔵中や翌年苗床に伏せ込んだ後に発病する可能性があるため、種イモは必ず未発生圃場から採取し、選別と消毒をした後に健全な苗床に伏せ込む。ウイルスフリー苗やバイオ苗を利用して育苗する場合も、苗が病原菌に感染している可能性は皆無ではないため、必ず苗消毒を行ってから健全な苗床に挿苗する。
苗床では、生育や葉色に異常のある株を見つけたら種イモごと速やかに苗床の外に持ち出し、適切に処分する。株元が変色していない萌芽苗でも基腐病菌を保菌している可能性があるため、苗は地際から5センチメートル以上離れた部分で採取し、当日調製したベノミル水和剤またはチウラム・ベノミル水和剤を用いて採苗と同時に消毒を行うことで発病リスクを低下できる。保菌苗を切ったハサミで健全苗を切ると、健全苗が病原菌に感染する恐れがあるため、採苗時のハサミはこまめに火炎滅菌または丁寧な水洗と拭き取りなどを行い、健全苗への病原菌の伝染を予防する。
なお、本圃へ定植する苗を購入する際には、(ア)適切な方法で生産された無病健全苗であること(イ)変色などの異常がないこと―を確認し、未消毒の苗であれば消毒してから本圃に定植する。
苗床で基腐病が発生した場合は、苗床から種イモを含め残渣を極力持ち出した上で、夏場に複数回耕うんし、残渣の分解を促進する。苗床の土壌消毒は、ダゾメット粉粒剤を用いて、地温、土壌水分など適切な条件下で実施する。土壌消毒効果を高めるため、薬剤処理後直ちにビニールなどで被覆する。
(2)「増やさない」対策
基腐病は、南九州の普通作では定植1カ月後頃から発生が認められる。発病株を圃場に残しておくと、発病部位に大量の胞子が形成され基腐病がまん延する原因となるため、圃場を定期的に巡回して発病株の早期発見と除去に努める。発病株は袋に入れるなどして、付着している土があたりに飛び散らないように圃場外へ持ち出し、圃場周辺に放置せずに適切に処分する。また、発病株除去後は、再発する可能性があるため補植はせず、周辺株を中心に薬剤を散布して感染を予防する。畝間に水がたまるような降雨後や台風通過後など、基腐病がまん延しやすい時期には薬剤の全面散布を行う。2021年8月現在、基腐病に対する茎葉散布剤として銅水和剤、炭酸水素ナトリウム・銅水和剤およびアゾキシストロビン水和剤が農薬登録されている。薬液は、葉よりも株元や茎に十分付着するよう散布する。また、罹病残渣が原因の土壌伝染による発病は長期間続き、薬剤散布での防除は難しくなるため、土壌の汚染が進んでいる地域では、必ず、土壌中の病原菌密度を低減させる対策として、後述する残渣の持ち出しや分解促進、輪作などを実施する。
基腐病菌は、主に地際の茎の感染部位からしょ梗、塊根へと侵入して腐敗症状を引き起こすため、発生圃場では早期収穫することで塊根の被害を軽減できる(ただし、収穫した塊根は、貯蔵中や出荷後輸送中に発病する可能性がある)。栽培期間が長くなるほど発病が進展し、罹病残渣を増やすことにもつながるため、発生が認められた圃場では栽培期間を短縮して早期に収穫し、地温が高いうちに耕うんなどして残渣の分解を促進することが望ましい。
基腐病は排水不良な場所でまん延しやすいため、作付け前に(ア)排水路を点検し堆積物を除く(イ)明渠を施工し排水路に接続する(ウ)排水を妨げる枕畝を設置しない(エ)サブソイラ(プラソイラなど)を用いて耕盤を破砕する―などして、表面排水、地下排水を促進する。基腐病は主に罹病残渣中で生き残った病原菌が次作の伝染源となるが、病原菌を含む土壌が作業機や長靴などに付着して移動することにより感染拡大が生じる可能性も考えられる。従って、農作業時は(ア)前年度に発生のない圃場から作業を行う(イ)作業後に機械や長靴を洗浄する―など、汚染土壌を拡散しない工夫も必要である。降雨後は圃場を見回り、排水が上手くいっているかを確認する。
国内主要かんしょ品種の基腐病抵抗性程度については、徐々に明らかになりつつある。単年度の圃場試験結果に基づく暫定的な評価であるが、塊根がオレンジ肉色の加工用品種「タマアカネ」は“強”、2019年に育成されたでん粉原料用品種「こないしん」は“やや強”、でん粉原料用の主力品種「シロユタカ」は“中”、焼酎原料用の主力品種「コガネセンガン」、および西日本を中心とする青果用の主力品種「高系14号」、関東を中心とする青果用の主力品種「ベニアズマ」、焼き芋や干し芋に使われる良食味の品種「べにはるか」は“やや弱”、低温糊化性でん粉を含むでん粉原料用品種「こなみずき」および通常でん粉原料用品種「ダイチノユメ」は“弱”である。国内における2019年産かんしょの作付面積は、「コガネセンガン」「べにはるか」「ベニアズマ」「高系14号」「シロユタカ」の順に多く、この5品種だけで全体の7割を占めている6)。程度の差はあるが、いずれの品種も基腐病には強くないため、かんしょを栽培する際には、基本的に基腐病の対策は必須であると考えられる。なお、抵抗性が強いと評価された品種でも全く感染しないわけではない。従って、抵抗性の強い品種を栽培する場合でも、種イモは未発生圃場から採取し、苗消毒などの基本対策を徹底するとともに、前作で発病の激しかった圃場での栽培は避ける。
基腐病菌はヒルガオ科植物にのみ感染し、作物ではかんしょのみ被害が知られている。前作で発生が認められた圃場では、かんしょを連作すると再び基腐病が発生し、罹病残渣などで病原菌が土壌中に集積し、圃場の汚染程度が高まると考えられる。従って、発生圃場ではかんしょの連作を避け、非宿主作物の栽培や休耕することを第一に考える。他作物の栽培または休耕の際には、基腐病菌が生き残る原因となる野良イモの発生に注意が必要である。また、その圃場の土壌は基腐病菌で汚染されていることにも留意し、作業機や長靴などで汚染土壌を拡散しないことも大切である。
基腐病菌は、主に地際の茎の感染部位からしょ梗、塊根へと侵入して腐敗症状を引き起こすため、発生圃場では早期収穫することで塊根の被害を軽減できる(ただし、収穫した塊根は、貯蔵中や出荷後輸送中に発病する可能性がある)。栽培期間が長くなるほど発病が進展し、罹病残渣を増やすことにもつながるため、発生が認められた圃場では栽培期間を短縮して早期に収穫し、地温が高いうちに耕うんなどして残渣の分解を促進することが望ましい。
基腐病は排水不良な場所でまん延しやすいため、作付け前に(ア)排水路を点検し堆積物を除く(イ)明渠を施工し排水路に接続する(ウ)排水を妨げる枕畝を設置しない(エ)サブソイラ(プラソイラなど)を用いて耕盤を破砕する―などして、表面排水、地下排水を促進する。基腐病は主に罹病残渣中で生き残った病原菌が次作の伝染源となるが、病原菌を含む土壌が作業機や長靴などに付着して移動することにより感染拡大が生じる可能性も考えられる。従って、農作業時は(ア)前年度に発生のない圃場から作業を行う(イ)作業後に機械や長靴を洗浄する―など、汚染土壌を拡散しない工夫も必要である。降雨後は圃場を見回り、排水が上手くいっているかを確認する。
国内主要かんしょ品種の基腐病抵抗性程度については、徐々に明らかになりつつある。単年度の圃場試験結果に基づく暫定的な評価であるが、塊根がオレンジ肉色の加工用品種「タマアカネ」は“強”、2019年に育成されたでん粉原料用品種「こないしん」は“やや強”、でん粉原料用の主力品種「シロユタカ」は“中”、焼酎原料用の主力品種「コガネセンガン」、および西日本を中心とする青果用の主力品種「高系14号」、関東を中心とする青果用の主力品種「ベニアズマ」、焼き芋や干し芋に使われる良食味の品種「べにはるか」は“やや弱”、低温糊化性でん粉を含むでん粉原料用品種「こなみずき」および通常でん粉原料用品種「ダイチノユメ」は“弱”である。国内における2019年産かんしょの作付面積は、「コガネセンガン」「べにはるか」「ベニアズマ」「高系14号」「シロユタカ」の順に多く、この5品種だけで全体の7割を占めている6)。程度の差はあるが、いずれの品種も基腐病には強くないため、かんしょを栽培する際には、基本的に基腐病の対策は必須であると考えられる。なお、抵抗性が強いと評価された品種でも全く感染しないわけではない。従って、抵抗性の強い品種を栽培する場合でも、種イモは未発生圃場から採取し、苗消毒などの基本対策を徹底するとともに、前作で発病の激しかった圃場での栽培は避ける。
基腐病菌はヒルガオ科植物にのみ感染し、作物ではかんしょのみ被害が知られている。前作で発生が認められた圃場では、かんしょを連作すると再び基腐病が発生し、罹病残渣などで病原菌が土壌中に集積し、圃場の汚染程度が高まると考えられる。従って、発生圃場ではかんしょの連作を避け、非宿主作物の栽培や休耕することを第一に考える。他作物の栽培または休耕の際には、基腐病菌が生き残る原因となる野良イモの発生に注意が必要である。また、その圃場の土壌は基腐病菌で汚染されていることにも留意し、作業機や長靴などで汚染土壌を拡散しないことも大切である。
(3)「残さない」対策
基腐病菌は、かんしょ残渣で越冬し次作の伝染源になるため、罹病残渣(特に分解しにくいしょ梗や腐敗塊根)は圃場外に持ち出し、地域のルールに従って適切に処分する。持ち出しできない残渣は、収穫後速やかに細断、耕うんなどを行ってすき込み、分解を促進することで次作の基腐病の発生を軽減できると考えられる。残渣の分解には土壌中の微生物が関与することから、20度以上の地温と適度な土壌水分が必要と考えられる。
土壌消毒を行っても、塊根など大きな残渣の内部に生存している病原菌は殺菌できないと考えられるため、土壌消毒を行う場合であっても罹病残渣を圃場外に持ち出し、持ち出しできない残渣は、病原菌が薬剤に暴露されるよう、土壌消毒前に耕うんなどを行って十分に分解する。土壌消毒は、ダゾメット粉粒剤など殺菌効果のある剤を使用し、地温、土壌水分など適切な条件下で実施し、処理時はビニールなどで被覆する。汚染程度が高い圃場では土壌消毒の効果は低いと考えられるため、かんしょ以外の作物を栽培することを検討する。
土壌消毒を行っても、塊根など大きな残渣の内部に生存している病原菌は殺菌できないと考えられるため、土壌消毒を行う場合であっても罹病残渣を圃場外に持ち出し、持ち出しできない残渣は、病原菌が薬剤に暴露されるよう、土壌消毒前に耕うんなどを行って十分に分解する。土壌消毒は、ダゾメット粉粒剤など殺菌効果のある剤を使用し、地温、土壌水分など適切な条件下で実施し、処理時はビニールなどで被覆する。汚染程度が高い圃場では土壌消毒の効果は低いと考えられるため、かんしょ以外の作物を栽培することを検討する。
(4)総合防除
基腐病は、種苗または圃場のどちらかでも病原菌に汚染されていれば発生する。圃場の株や貯蔵中の塊根の発病は、よく注意して見ないと気付きにくく、いつの間にか病原菌を増やし、拡散してしまう可能性がある。基腐病に特効薬はない。上述した対策を単独で実施しても防除は難しく、すべての対策を基腐病菌の付け入る隙なく着実に実施する必要がある。また、台風など激しい風雨により、基腐病の被害が隣接圃場に拡大したと推察される事例もあるため、基腐病対策は、点ではなく面で、地域全体で対策に取り組む必要がある。
(5)海外の対策を参考にした防除技術開発
基腐病(英名:Foot Rot)は、1912年に初めて米国で発生が報告されたが7)、米国では種苗管理を改善し、現在では発生の珍しい病害となっている8)。一方、ブラジルでは、1990年代に本病原菌に感染した苗を圃場に植え付けたことで著しい被害が発生した。本病は、アルゼンチンやウルグアイなどでも問題となっているが、最近では2008年に台湾9)、2014年に中国10)、2015年に韓国11)と、東アジアでも次々に発生が確認されている。
米国では、基腐病は適切な衛生管理が日常的に行われていれば問題にならない病気とされており、効果的な防除対策として、無病種イモの選抜、種イモ消毒、苗床や本圃における輪作を挙げている8)。ブラジルでは抵抗性品種の存在が明らかになっている。また、台湾では、健全苗の使用、発病株の抜き取り、発生圃場の湛水または稲や非宿主作物との輪作を12)、中国ではソルガムやトウモロコシとの輪作を推奨している10)。これら海外での対策を参考に、現在、圃場の湛水による発病抑制効果を検証中であり、今後、非宿主作物との輪作についても、その効果を検証する予定である。また、海外から導入した基腐病抵抗性を持つとされるかんしょ野生種および栽培品種について抵抗性程度を確認しているところであり、今後、抵抗性品種育成への利用が期待される。
米国では、基腐病は適切な衛生管理が日常的に行われていれば問題にならない病気とされており、効果的な防除対策として、無病種イモの選抜、種イモ消毒、苗床や本圃における輪作を挙げている8)。ブラジルでは抵抗性品種の存在が明らかになっている。また、台湾では、健全苗の使用、発病株の抜き取り、発生圃場の湛水または稲や非宿主作物との輪作を12)、中国ではソルガムやトウモロコシとの輪作を推奨している10)。これら海外での対策を参考に、現在、圃場の湛水による発病抑制効果を検証中であり、今後、非宿主作物との輪作についても、その効果を検証する予定である。また、海外から導入した基腐病抵抗性を持つとされるかんしょ野生種および栽培品種について抵抗性程度を確認しているところであり、今後、抵抗性品種育成への利用が期待される。
おわりに
本稿では、主に生研支援センター「イノベーション創出強化研究推進事業」の支援を受けて実施した共同研究の成果を紹介した。研究成果は「サツマイモ基腐病の発生生態と防除対策(令和2年度版)」(http://www.naro.affrc.go.jp/publicity_report/publication/pamphlet/tech-pamph/138589.html)としてマニュアル化しているので、こちらも参考にしてほしい。
【参考文献】
1)小林有紀(2019)「サツマイモ基腐病(仮称)の発生と対策」『植物防疫』(73)pp.29-33.
2)Clark, C.A., Moyer J.W.(2013)「Dry rot」『Compendium of sweetpotato diseases, pests, and disorders, second edition』pp.57-58. APS Press, USA.
3)小林有紀・西八束・西岡一也・櫛間義幸・臼井真奈美・小林晃・岡田吉弘(2021)「南九州におけるサツマイモ基腐病菌およびサツマイモ乾腐病菌の分離と病原性比較」『日植病報』(87)p.54.(講要)
4)Fujiwara, K., Kobayashi, Y.O., Usui, M., Nishioka, K., Nakamura, M., Kawano, S., Okada, Y., Kobayashi, A., Miyasaka, A., Hirayae, K., Kushima, Y., Nishi, Y., Inoue, H.(2021)「Real-time PCR assay for the diagnosis and quantification co-infections by Diaporthe batatas and Diaporthe destruens in sweet potato」『Front. plant sci.』(12)pp.1-11.
5)Clark, C.A. (2013)「Bacterial stem and root rot」『Compendium of sweetpotato diseases, pests, and disorders, second edition』pp.11-14. APS Press, USA.
6)農林水産省(2021)「かんしょ品種の普及状況」『令和2年度いも・でん粉に関する資料』<https://www.maff.go.jp/j/seisan/tokusan/imo/r2shiryou.html>(2021/9/10アクセス)
7)Harter, L.(1913)「Foot-rot, a new disease of the sweet potato」『Phytopathology』 (3)pp.243-245.
8)Clark, C.A., Moyer J.W.(2013)「Foot rot」『Compendium of sweetpotato diseases, pests, and disorders, second edition』pp.36〜37. APS Press, USA.
9)Lin, C.Y., Huang, C.W., Yang, H.R., Lai, S.Y., Ni H.F.(2017)「A method for the specific detection of Phomopsis destruens in sweet potato by PCR」『J. Taiwan Agric. Res.』(66)pp.276-285.
10)Gai, Y., Ma, H., Chen, X., Zheng, J., Chen, H., Li, H.(2016)「Stem blight, foot rot and storage tuber rot of sweet potato caused by Plenodomus destruens in China」『J. Gen. Plant Pathol.』(82)pp.181-185.
11)Paul, N.C., Nam, S.S., Park, W., Yang. J.W., Kachroo, A.(2019)「First report of storage tuber rot in sweetpotato (Ipomoea batatas) caused by Plenodomus destruens in Korea」『Plant Dis.』(103)p.1020.
12)Huang, C.W., Yang, H.R., Lin, C.Y., Hsu, S.L.,Ni, H.F.(2015)「Occurrence, pathogen characterization and control of Pphomopsis destruens causing foot rot of sweet potato」『台灣新浮現之重要作物病害及其防治研討會專刊』(184)pp.87-98.
1)小林有紀(2019)「サツマイモ基腐病(仮称)の発生と対策」『植物防疫』(73)pp.29-33.
2)Clark, C.A., Moyer J.W.(2013)「Dry rot」『Compendium of sweetpotato diseases, pests, and disorders, second edition』pp.57-58. APS Press, USA.
3)小林有紀・西八束・西岡一也・櫛間義幸・臼井真奈美・小林晃・岡田吉弘(2021)「南九州におけるサツマイモ基腐病菌およびサツマイモ乾腐病菌の分離と病原性比較」『日植病報』(87)p.54.(講要)
4)Fujiwara, K., Kobayashi, Y.O., Usui, M., Nishioka, K., Nakamura, M., Kawano, S., Okada, Y., Kobayashi, A., Miyasaka, A., Hirayae, K., Kushima, Y., Nishi, Y., Inoue, H.(2021)「Real-time PCR assay for the diagnosis and quantification co-infections by Diaporthe batatas and Diaporthe destruens in sweet potato」『Front. plant sci.』(12)pp.1-11.
5)Clark, C.A. (2013)「Bacterial stem and root rot」『Compendium of sweetpotato diseases, pests, and disorders, second edition』pp.11-14. APS Press, USA.
6)農林水産省(2021)「かんしょ品種の普及状況」『令和2年度いも・でん粉に関する資料』<https://www.maff.go.jp/j/seisan/tokusan/imo/r2shiryou.html>(2021/9/10アクセス)
7)Harter, L.(1913)「Foot-rot, a new disease of the sweet potato」『Phytopathology』 (3)pp.243-245.
8)Clark, C.A., Moyer J.W.(2013)「Foot rot」『Compendium of sweetpotato diseases, pests, and disorders, second edition』pp.36〜37. APS Press, USA.
9)Lin, C.Y., Huang, C.W., Yang, H.R., Lai, S.Y., Ni H.F.(2017)「A method for the specific detection of Phomopsis destruens in sweet potato by PCR」『J. Taiwan Agric. Res.』(66)pp.276-285.
10)Gai, Y., Ma, H., Chen, X., Zheng, J., Chen, H., Li, H.(2016)「Stem blight, foot rot and storage tuber rot of sweet potato caused by Plenodomus destruens in China」『J. Gen. Plant Pathol.』(82)pp.181-185.
11)Paul, N.C., Nam, S.S., Park, W., Yang. J.W., Kachroo, A.(2019)「First report of storage tuber rot in sweetpotato (Ipomoea batatas) caused by Plenodomus destruens in Korea」『Plant Dis.』(103)p.1020.
12)Huang, C.W., Yang, H.R., Lin, C.Y., Hsu, S.L.,Ni, H.F.(2015)「Occurrence, pathogen characterization and control of Pphomopsis destruens causing foot rot of sweet potato」『台灣新浮現之重要作物病害及其防治研討會專刊』(184)pp.87-98.
このページに掲載されている情報の発信元
農畜産業振興機構 調査情報部 (担当:企画情報グループ)
Tel:03-3583-9272
農畜産業振興機構 調査情報部 (担当:企画情報グループ)
Tel:03-3583-9272