ホーム > 砂糖 > 調査報告 > その他 > 酢酸菌によるセルロース合成と発酵ナノセルロース(NFBC)の大量生産
最終更新日:2014年4月10日
酢酸菌によるセルロース合成と発酵ナノセルロース(NFBC)の大量生産
2014年4月
北海道大学大学院工学研究院 生物機能高分子部門 准教授 田島 健次
東京農工大学大学院農学研究院 環境資源物質科学部門 助教 小瀬 亮太
日本甜菜製糖株式会社 総合研究所 第二グループ 主席研究員 櫻井 博章
【要約】
フルーツを分離源として、セルロース(バクテリアセルロース(BC))を合成可能な新奇酢酸菌を取得した。培養条件の検討を行い、糖蜜を原料として大型の微生物培養装置(ファーメンター)を用いることにより、発酵ナノセルロース(ナノフィブリル化BC)の大量生産に成功した。
はじめに
セルロースのほとんどは植物によって合成されるが、動物、藻類、バクテリアもセルロースを合成することが知られている。中でも、バクテリアによって合成されるセルロースはバクテリアセルロース(以下「BC」という)と呼ばれている。最も代表的なBC合成菌は、絶対好気性菌である酢酸菌(Gluconacetobacter )であり1)、約50〜100 ナノメートル程度のセルロースナノファイバーを菌体外に分泌する。セルロースは植物、バクテリアともにセルロース合成酵素複合体「ターミナルコンプレックス(TC)」によって合成されていると考えられているが、その構造や機能については完全には明らかとなっていない。一般的にBCは、静置培養法と呼ばれる方法によってセルロースナノファイバーの3次元ネットワーク構造体であるゲル状膜(ペリクル)として調製される。このペリクルは高い保水性、高強度、生体適合性などの非常にユニークな性質を有しており、これらの特性を生かしたさまざまな用途開発が行われている2,3,4)。しかしながら、ナノファイバーの強固な3次元ネットワーク構造を有するペリクルは、成形性、混和性、流動性に乏しく、そのままの形では材料としての応用範囲が限定されてしまうという側面も有している。
また近年、ナノサイズのセルロース素材(ナノフィブリル化セルロース(以下「NFC」という))が新規材料として注目を浴びている5,6)。一般に、 NFCは植物繊維を原料として、物理的・化学的処理によってトップダウン的に調製され、得られた NFCは水中に高分散している7,8)。対照的に、BCの場合は、酢酸菌の培養条件などを最適化することにより低分子からボトムアップ的にNFCを調製することが可能である9)。さらに、炭素源として、グルコースやフルクトースなどの糖類やグリセリンなど、さまざまな物質を用いることができる10,11)。
BCは上述のように新規材料として注目されているが、製造コストが高く、実用化があまり進んでいないというのが実状である。コストを下げるためのアプローチとしては培養条件(培地組成、培養方法)の最適化、菌の改良(高生産菌のスクリーニング、遺伝子組み換え)など、さまざまなアプローチがあるが、安価な炭素源の使用もその一つである。バクテリアが栄養源として利用可能でしかも安価なものとして廃グリセリン、糖蜜などがある。廃グリセリンとは、バイオディーゼル燃料(BDF)を製造する際に、また糖蜜は砂糖を製造する際に生じる副産物のことであり、廃グリセリンには、高濃度のグリセリン(約45%)が12)、糖蜜にはスクロース、グルコースなど(約70%)が含まれている。そして、北海道大学と北海道において、てん菜を原料に砂糖製造を行っている日本甜菜製糖株式会社との共同研究により、フルーツの表面から単離した新奇酢酸菌13)と糖蜜を用いたナノフィブリル化BC (NFBC、「発酵ナノセルロース」と命名)の大量生産に成功した。
本稿では、酢酸菌におけるセルロース合成、およびNFBCの大量生産について解説する。
また近年、ナノサイズのセルロース素材(ナノフィブリル化セルロース(以下「NFC」という))が新規材料として注目を浴びている5,6)。一般に、 NFCは植物繊維を原料として、物理的・化学的処理によってトップダウン的に調製され、得られた NFCは水中に高分散している7,8)。対照的に、BCの場合は、酢酸菌の培養条件などを最適化することにより低分子からボトムアップ的にNFCを調製することが可能である9)。さらに、炭素源として、グルコースやフルクトースなどの糖類やグリセリンなど、さまざまな物質を用いることができる10,11)。
BCは上述のように新規材料として注目されているが、製造コストが高く、実用化があまり進んでいないというのが実状である。コストを下げるためのアプローチとしては培養条件(培地組成、培養方法)の最適化、菌の改良(高生産菌のスクリーニング、遺伝子組み換え)など、さまざまなアプローチがあるが、安価な炭素源の使用もその一つである。バクテリアが栄養源として利用可能でしかも安価なものとして廃グリセリン、糖蜜などがある。廃グリセリンとは、バイオディーゼル燃料(BDF)を製造する際に、また糖蜜は砂糖を製造する際に生じる副産物のことであり、廃グリセリンには、高濃度のグリセリン(約45%)が12)、糖蜜にはスクロース、グルコースなど(約70%)が含まれている。そして、北海道大学と北海道において、てん菜を原料に砂糖製造を行っている日本甜菜製糖株式会社との共同研究により、フルーツの表面から単離した新奇酢酸菌13)と糖蜜を用いたナノフィブリル化BC (NFBC、「発酵ナノセルロース」と命名)の大量生産に成功した。
本稿では、酢酸菌におけるセルロース合成、およびNFBCの大量生産について解説する。
1. バクテリアセルロース(BC)
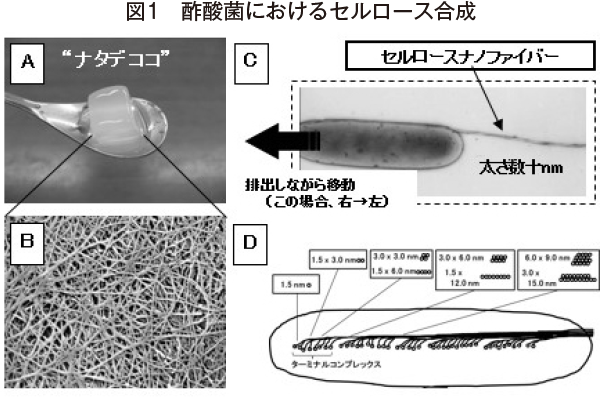
さまざまなバクテリアがセルロースを合成することが報告されているが、最も古くから研究が行われているのが酢酸菌(Gluconacetobacter = Acetobacter )である1)。酢酸菌は、絶対好気性・グラム陰性の桿菌で、天然においてはフルーツの表面などに生息している。酢酸菌の大きさは1マイクロメートル×5マイクロメートル程度で(図1−C)、1本の繊維(セルロースリボン)を合成・排出し、それに伴って移動する(図1−C)。糖などを含む液体培地中で静置培養を行うと、図1−Bに示すようなナノファイバーの緻密なネットワーク構造を有するゲル状の膜が作られる。BCの特徴として以下のような点が挙げられる。(1)リグニン・ヘミセルロース不含、(2)微細繊維(幅数十nm程度)、(3)非常に発達したネットワーク構造、(4)高い機械的強度、(5)生分解性、(6)生体適合性、(7)保水性。BCの応用例として最も古くから知られているのが、“ナタデココ”というデザートである(図1−A)。15年ほど前に日本でもブームとなり、現在でもさまざまな形態でナタデココを含む食品が売られている。“ナタ”は液上に浮く膜、“ココ”はココナッツの意味で、ココナッツ水の上にできる膜がナタデココである。ナタデココはバクテリアによって作られるが、そのコリコリとした食感はナノオーダーの繊維による緻密なネットワーク構造によるものである(セルロース含有量はナタデココ全体の約0.5%程度)。また、そのユニークな構造と物性を利用した応用例として、スピーカーの音響振動板、人工血管、創傷被覆材、UVカット材、高強度透明材料、表示デバイスなどがあり、デザートから先端材料まで幅広い応用が可能である。
2. 酢酸菌におけるセルロース合成
通常、酢酸菌はグルコースなどの糖質を炭素源としてセルロースを合成する。菌体に取り込まれたグルコースはグルコース−6−リン酸、グルコース−1−リン酸、ウリジン2リン酸−グルコース(UDG−グルコース)を経てグルカン鎖が合成される。セルロース合成を実際に行っているのは、セルロース合成酵素複合体(ターミナルコンプレックス=TC)である。酢酸菌において、TCは細胞膜の1カ所に直線状に局在していることが分かっており(図1−D)、TCには少なくともAxCeSA、 AxCeSB、AxCeSC、AxCeSDの4つのサブユニットが含まれていると考えられている。セルロース合成におけるAxCeSA、AxCeSB、AxCeSC、 AxCeSDの機能はそれぞれ、AxCeSA:グルコースの重合(糖転移反応)、AxCeSB:セルロース合成の制御、AxCeSC:グルカン鎖排出のための孔の形成、 AxCeSD:グルカン鎖の排出・結晶化、と推定されており、AxCeSA−Cについては遺伝子欠損によってセルロース合成能の欠失、AxCeSDについてはセルロース生産量のかなりの減少が見られる14)。
3. NFBC(発酵ナノセルロース)の創製
酢酸菌を用いて効率的にセルロースを合成する方法として、カルボキシメチルセルロース(CMC)などの水溶性セルロース誘導体を添加した培地による撹拌培養がある9)。これまでに、CMCを培地に添加した場合の酢酸菌の繊維生産挙動に関する報告は数多くなされており、CMCが培地中に存在することによりミクロフィブリルの自己組織化が妨げられ、繊維幅、結晶サイズが低下することが知られている15,16)。通常、菌体外でミクロフィブリルまたはミクロフィブリルの束が自己組織化してリボン状のナノファイバーが形成されるが、CMC を培地に添加することによりCMCがミクロフィブリルおよびその束の表面で相互作用し吸着するために自己組織化が妨げられ、結果として50ナノメートル幅のリボン状繊維よりも細いナノファイバーが形成される。
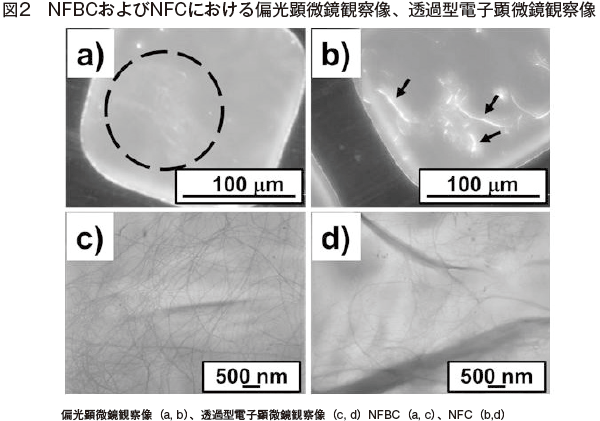
図2−a,c)は、CMCを添加した培地でファーメンターを用いた通気撹拌培養を行うことにより得られた高分散性セルロースナノファイバーである。対照試料として、木質由来精製パルプを機械的処理して得られた市販のセルロースナノファイバーを示している(図2−b,d))。図2−b,d)では、マイクロまたはサブマイクロメートルスケールのファイバーが観察されているのに対し、図2−a,c)では同サイズのファイバーは観察されていない。トップダウン型でセルロースナノファイバーを調製する場合、ナノファイバーが調製されると同時にサブマイクロ、マイクロファイバーがわずかではあるが残存してしまう可能性がある。一方、バクテリアを用いたボトムアップ型ではそもそもサブマイクロメートルスケール以上のファイバーは存在しておらず、培養条件を最適化することにより、均質なナノファイバーを調製することが可能である。
4. まとめ
セルロースナノファイバー分野で、近年実用化に向けて盛んに研究されているのは、木材パルプを原料とした物理的・化学的処理によるトップダウン型の調製方法である。一方、現状において原料コスト、生産コストにハードルはあるものの、バクテリアを用いたボトムアップ型の製造方法では、セルロースを含まないさまざまな未利用資源を原料にできる点、均質な高分子量のセルロースナノファイバーが得られる点など、トップダウン型とは異なる特徴がある。今後ますます環境調和・循環型社会の形成が求められる中で、本手法がセルロースナノファイバー調製法の一つとして実用化されることを期待する。なお、現在、NFBCの大量生産に関しては北海道大学と日本甜菜製糖株式会社で共同研究を行っており、平均幅20ナノメートルの均一なセルロースナノファイバー(NFBC)が高分散化した懸濁液を、百キロ単位で調製することに成功した。今後、更に量産化・低コスト化を進め、サンプル出荷を経て商品化する予定である。
謝辞
本総説は、以下の多くの皆さま方との共同研究による成果をまとめたものです: 砂川直輝、吉田誠(敬称略、順不同)。電子顕微鏡撮影に関して、北海道大学大学院工学研究院の大久保賢二氏に多大なご協力を頂きました。廃グリセリンは北清企業株式会社より、糖蜜は日本甜菜製糖株式会社よりご提供頂きました。また、本稿にはNEDO先導的産業技術創出事業(11B12009)、地域イノベーションクラスタープログラム(グローバル型)の助成、および北海道大学において「文部科学省 ナノテクノロジープラットホーム事業」を通じた技術的支援を受けて実施された研究成果が含まれています。皆さま方に厚く御礼申し上げます。
参考文献
1) Brown, A. J., J. Chem. Soc., 49, 432 (1886).
2) Ross, P. et al., Microbiol. Rev., 55, 35 (1991).
3) Nogi, M. and Yano, H., Adv. Mater., 20, 1849 (2008).
4) Czaja, W. et al., Biomaterials, 27, 145 (2006).
5) Missoum, K. et al., Materials, 6, 1745 (2013).
6) Eichhorn, S. J. et al., J. Mater. Sci., 45, 1 (2010).
7) Saito, T. et al., Biomacromolecules, 7, 1687 (2006).
8) Abe, K. and Yano, H., Cellulose, 16, 1017 (2009).
9) Warashina, S. et al., セルロース学会第17回年次大会 2010 cellulose R & D 講演要旨集, 98 (2010).
10)Sunagawa, N. et al., Cellulose, 19, 1989 (2012).
11)Keshk, S. M. A. S. and Sameshima, K., Afr. J. Biotechnol., 4, 478 (2005).
12)Karinen, R. S. and Krause, A. O. I., Appl. Catal. AGen., 306, 128 (2006).
13)Kose, R. et al., Cellulose, 20, 2971 (2013).
14)Saxena, I. M. et al., J. Bacteriol., 176, 5735 (1994).
15)Cheng, K. C. et al., Cellulose, 16, 1033 (2009).
16)Cheng, K. C. et al., Biomacromolecules, 12, 730 (2011).
参考文献
1) Brown, A. J., J. Chem. Soc., 49, 432 (1886).
2) Ross, P. et al., Microbiol. Rev., 55, 35 (1991).
3) Nogi, M. and Yano, H., Adv. Mater., 20, 1849 (2008).
4) Czaja, W. et al., Biomaterials, 27, 145 (2006).
5) Missoum, K. et al., Materials, 6, 1745 (2013).
6) Eichhorn, S. J. et al., J. Mater. Sci., 45, 1 (2010).
7) Saito, T. et al., Biomacromolecules, 7, 1687 (2006).
8) Abe, K. and Yano, H., Cellulose, 16, 1017 (2009).
9) Warashina, S. et al., セルロース学会第17回年次大会 2010 cellulose R & D 講演要旨集, 98 (2010).
10)Sunagawa, N. et al., Cellulose, 19, 1989 (2012).
11)Keshk, S. M. A. S. and Sameshima, K., Afr. J. Biotechnol., 4, 478 (2005).
12)Karinen, R. S. and Krause, A. O. I., Appl. Catal. AGen., 306, 128 (2006).
13)Kose, R. et al., Cellulose, 20, 2971 (2013).
14)Saxena, I. M. et al., J. Bacteriol., 176, 5735 (1994).
15)Cheng, K. C. et al., Cellulose, 16, 1033 (2009).
16)Cheng, K. C. et al., Biomacromolecules, 12, 730 (2011).
このページに掲載されている情報の発信元
農畜産業振興機構 調査情報部 (担当:企画情報グループ)
Tel:03-3583-8678
農畜産業振興機構 調査情報部 (担当:企画情報グループ)
Tel:03-3583-8678