最終更新日:2015年9月10日
第3の機能性食品制度
2015年9月
宮城大学名誉教授 池戸 重信
(内閣府消費者委員会食品表示部会委員)
1. 新たな機能性食品制度創設の経緯
これまで国が定めた基準や規定に基づく健康食品は、栄養機能食品(マークなし)と、特定保健用食品(マークあり)の2種のみであったが、届出制による機能性表示食品制度(以下「新制度」という)が第3の公的制度として施行された。食品は、栄養機能(第1次機能)やおいしさ等の感覚機能(第2次機能)を有するが、今回対象とする機能とは、生体の生理機能を調整する働き(体調調節機能)のことを言い、第3次機能とも呼ばれている。
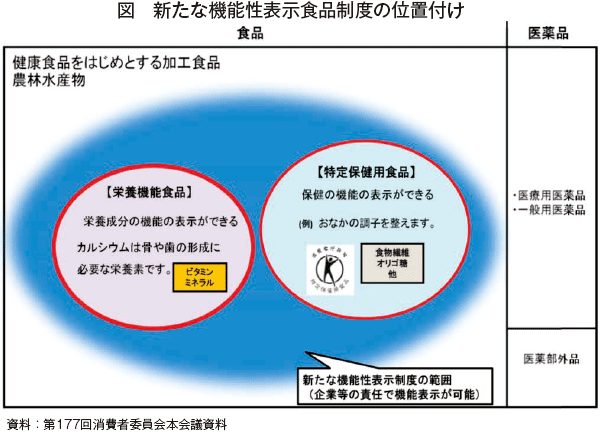
現在、国の基準や認定に基づかない機能性食品や各種の補助食品・サプリメントもかなりの市場を占めているが、これらは認定等を受けたものと区別して、「いわゆる健康食品」と呼ばれており、新制度は、こうした分野の中から、安全性、機能性等に関して根拠あるデータに基づき、企業責任の下での国への届出により機能表示を可能としたものである(図)。
高齢化の進展や健康志向の増大等により、当該健康食品市場は1.5兆円以上、潜在需要はその倍の3兆円以上が期待できると言われている。
新制度は、一昨年6月に閣議決定された規制改革基本計画に基づくもので、その具体的な方策については、民間が有しているノウハウを活用する観点から、その食品の機能性について、国ではなく企業等が自らその科学的根拠を評価した上で、その旨および機能を表示できる米国のダイエタリーサプリメント(DS)の表示制度を参考にしたものであるが、わが国では機能性の科学的根拠等について、より厳しい要件を課している。
また、新制度では、生鮮食品(農林水産物)も対象となっている点が特徴の一つである。
現在、国の基準や認定に基づかない機能性食品や各種の補助食品・サプリメントもかなりの市場を占めているが、これらは認定等を受けたものと区別して、「いわゆる健康食品」と呼ばれており、新制度は、こうした分野の中から、安全性、機能性等に関して根拠あるデータに基づき、企業責任の下での国への届出により機能表示を可能としたものである(図)。
高齢化の進展や健康志向の増大等により、当該健康食品市場は1.5兆円以上、潜在需要はその倍の3兆円以上が期待できると言われている。
新制度は、一昨年6月に閣議決定された規制改革基本計画に基づくもので、その具体的な方策については、民間が有しているノウハウを活用する観点から、その食品の機能性について、国ではなく企業等が自らその科学的根拠を評価した上で、その旨および機能を表示できる米国のダイエタリーサプリメント(DS)の表示制度を参考にしたものであるが、わが国では機能性の科学的根拠等について、より厳しい要件を課している。
また、新制度では、生鮮食品(農林水産物)も対象となっている点が特徴の一つである。
2. 安全性の確保の在り方
具体的な新制度の根幹は、 1)安全性確保の在り方、 2)機能性表示を行うに当たって必要な科学的根拠の考え方、 3)消費者にとって誤認のない機能性表示の在り方、 4)国の関与の在り方、という4つの重要な柱からなっている。
食品は、まずは安全であることが基本である。一般に、個々の食品の安全性については、それらの長い食経験を通じて担保されてきたものであることから、具体的な情報に基づき食経験を評価することが適当である。例えば、食習慣等を踏まえた機能性関与成分または含有食品の日常的な摂取量、市販食品の販売期間、これまでの販売量、機能性関与成分の含有量、摂取集団(年齢、性別、健康状態、規模等)、摂取形状、摂取方法、摂取頻度等に関する調査が必要とされる。
かつ、全国規模で、機能性を表示する食品の摂取集団より広範囲の摂取集団において、同等以上の摂取量での、一定期間の喫食実績があることが求められる。なお、届け出た機能性関与成分または最終製品についての食経験を評価するに当たり、「既に流通している当該食品と同じもの」で食経験を評価する以外に、「当該食品と類似する食品」からでも評価できることとなっている。
食品は、まずは安全であることが基本である。一般に、個々の食品の安全性については、それらの長い食経験を通じて担保されてきたものであることから、具体的な情報に基づき食経験を評価することが適当である。例えば、食習慣等を踏まえた機能性関与成分または含有食品の日常的な摂取量、市販食品の販売期間、これまでの販売量、機能性関与成分の含有量、摂取集団(年齢、性別、健康状態、規模等)、摂取形状、摂取方法、摂取頻度等に関する調査が必要とされる。
かつ、全国規模で、機能性を表示する食品の摂取集団より広範囲の摂取集団において、同等以上の摂取量での、一定期間の喫食実績があることが求められる。なお、届け出た機能性関与成分または最終製品についての食経験を評価するに当たり、「既に流通している当該食品と同じもの」で食経験を評価する以外に、「当該食品と類似する食品」からでも評価できることとなっている。
3. 機能性の科学的根拠と品質管理体制
一方、表示しようとする機能性の科学的根拠を説明するものとして、 1)最終製品を用いた臨床試験、 2)最終製品または機能性関与成分に関する研究レビューのいずれかによる資料を用意しなければならない。米国のDS制度では、科学的根拠の明確性に欠けたものであったことから、わが国ではより厳格な要件を課した制度となっている。
また、当該食品については、常に安全性が確保されているとともに、届け出た際の機能性評価値が常時保たれた製品が提供されることが必要である。そのため、届出に当たっては、生産・製造における衛生管理および品質管理の観点から、安全性を確保していることを説明するものとして、 a)生産・製造および品質管理の体制、b)食品中の機能性関与成分等の分析に係る資料を用意する必要がある。このうち a)について、サプリメント形状の加工食品またはその他加工食品に関しては、 ア)わが国のGMP(適正製造規範)、もしくは米国のGMPの認証機関の認証を取得した方法、 イ)総合衛生管理製造過程(食品衛生法におけるHACCP)、もしくは地方自治体の実施するHACCPの承認を取得した方法、 ウ)ISO22000、もしくはFSSC22000の認証機関の認証を取得した方法のいずれかで製造する場合等が該当する。
一方、生鮮食品については、生産・採取・漁獲等の衛生管理体制としては、採取に関して「食品等事業者が実施すべき管理運営基準に関する指針」(平成16年2月27日付け食安発第0227012号別添)等を参考にすることや生鮮食品の均質性とその管理体制、製品規格、規格外の製品の流通を防止するための体制等に関する届出が求められる。
また、当該食品については、常に安全性が確保されているとともに、届け出た際の機能性評価値が常時保たれた製品が提供されることが必要である。そのため、届出に当たっては、生産・製造における衛生管理および品質管理の観点から、安全性を確保していることを説明するものとして、 a)生産・製造および品質管理の体制、b)食品中の機能性関与成分等の分析に係る資料を用意する必要がある。このうち a)について、サプリメント形状の加工食品またはその他加工食品に関しては、 ア)わが国のGMP(適正製造規範)、もしくは米国のGMPの認証機関の認証を取得した方法、 イ)総合衛生管理製造過程(食品衛生法におけるHACCP)、もしくは地方自治体の実施するHACCPの承認を取得した方法、 ウ)ISO22000、もしくはFSSC22000の認証機関の認証を取得した方法のいずれかで製造する場合等が該当する。
一方、生鮮食品については、生産・採取・漁獲等の衛生管理体制としては、採取に関して「食品等事業者が実施すべき管理運営基準に関する指針」(平成16年2月27日付け食安発第0227012号別添)等を参考にすることや生鮮食品の均質性とその管理体制、製品規格、規格外の製品の流通を防止するための体制等に関する届出が求められる。
4. 求められる表示要件と届出制
新制度の対象食品は食品全般とするが、特別用途食品、栄養機能食品と重複することはできない。また、アルコールを含有する飲料は対象外とされる。さらに、国民の栄養摂取の状況から見て、 1)脂質、 2)飽和脂肪酸、 3)コレステロール、 4)単糖類または二糖類であって糖アルコールでないもの、 5)ナトリウムといった過剰な摂取につながる食品も対象外となっている。
一方、可能な機能性表示の範囲としては、保健の目的が期待できる旨の表示の範囲として、健康の維持および増進に役立つ、または適する旨(疾病リスクの低減に資する旨を除く)を表現するものであり、「診断」「予防」「治療」「回復」「緩和」「処置」等の医学的な表現は使用できないが、身体の特定の部位に言及した表現は可能である。また、特定保健用食品で認められている範囲内の表現も可能である(疾病リスク低減表示を除く)。
また、表示項目としては、通常の食品に課されている事項以外に、機能性表示食品である旨、機能性関与成分および当該成分または当該成分を含有する食品が有する機能性、一日当たりの摂取目安量当たりの機能性関与成分の含有量等十数項目が必要となる。なお、販売の60日前までに消費者庁に届け出ることになっており、受理された場合、当該食品についての情報が消費者庁のホームページで公表されることになっていることから、これらを参考にすることが有効である。
一方、可能な機能性表示の範囲としては、保健の目的が期待できる旨の表示の範囲として、健康の維持および増進に役立つ、または適する旨(疾病リスクの低減に資する旨を除く)を表現するものであり、「診断」「予防」「治療」「回復」「緩和」「処置」等の医学的な表現は使用できないが、身体の特定の部位に言及した表現は可能である。また、特定保健用食品で認められている範囲内の表現も可能である(疾病リスク低減表示を除く)。
また、表示項目としては、通常の食品に課されている事項以外に、機能性表示食品である旨、機能性関与成分および当該成分または当該成分を含有する食品が有する機能性、一日当たりの摂取目安量当たりの機能性関与成分の含有量等十数項目が必要となる。なお、販売の60日前までに消費者庁に届け出ることになっており、受理された場合、当該食品についての情報が消費者庁のホームページで公表されることになっていることから、これらを参考にすることが有効である。
5. 届出状況
当該食品は、サプリメント形状の加工食品、その他の加工食品および生鮮食品の3種に分けての対応が示されている。
現時点(平成27年8月31日)までに77件の届出が受理され、消費者庁のホームページで情報が開示されているが、このうち、サプリメント形状の加工食品が43件およびその他の加工食品が34件となっており、生鮮食品の実績はない。
新制度は、生鮮食品(農林水産物)も対象となっており、特産食材の高付加価値化等を通した、地域産業の振興面でも期待されている。
この場合、生鮮食品としてではなく、加工食品の原材料としての生産拡大も可能性を有しており、現にこれまでにも、葛の花由来のイソフラボン、米由来のグルコシルセラミド、茶のメチル化カテキン、甘草由来のグラブリジン等、植物(作物)由来物質の活用による製品が示されており、今後この分野の国産振興につながる対応が期待される。
ただし、生鮮食品の場合、製品化の際の機能性関与成分のバラツキ等の問題や効率的な成分評価手法の開発等、特有の課題解決が必要なことも事実で、国および公設研究機関と連携した取り組みが求められている。
現時点(平成27年8月31日)までに77件の届出が受理され、消費者庁のホームページで情報が開示されているが、このうち、サプリメント形状の加工食品が43件およびその他の加工食品が34件となっており、生鮮食品の実績はない。
新制度は、生鮮食品(農林水産物)も対象となっており、特産食材の高付加価値化等を通した、地域産業の振興面でも期待されている。
この場合、生鮮食品としてではなく、加工食品の原材料としての生産拡大も可能性を有しており、現にこれまでにも、葛の花由来のイソフラボン、米由来のグルコシルセラミド、茶のメチル化カテキン、甘草由来のグラブリジン等、植物(作物)由来物質の活用による製品が示されており、今後この分野の国産振興につながる対応が期待される。
ただし、生鮮食品の場合、製品化の際の機能性関与成分のバラツキ等の問題や効率的な成分評価手法の開発等、特有の課題解決が必要なことも事実で、国および公設研究機関と連携した取り組みが求められている。
このページに掲載されている情報の発信元
農畜産業振興機構 調査情報部 (担当:企画情報グループ)
Tel:03-3583-8678
農畜産業振興機構 調査情報部 (担当:企画情報グループ)
Tel:03-3583-8678