ホーム > 砂糖 > 調査報告 > さとうきび > サトウキビの品質劣化に関する報告
最終更新日:2017年9月11日
サトウキビの品質劣化に関する報告
2017年9月
ミトポンサトウキビ研究所(Mitr Phol Sugarcane Research Center) 渡邉 健太
【要約】
サトウキビの品質劣化は、栽培、収穫から原料糖、精製糖の製造まであらゆる過程で見られる現象で、歩留まりに大きな影響を与える要因である。品質劣化に関する基礎的な知見からその問題点や対策など製糖業界、研究機関にとって考慮すべき重要な点について取りまとめたので報告する。
はじめに
著者の勤務するミトポンサトウキビ研究所(注)(Mitr Phol Sugarcane Research Center、タイ王国)では、定期的に各専門分野のトップに位置する海外研究者を招き、研究員のレベルアップを目的としたセミナーを開催している。2017年5月3日には、米国ルイジアナ州農務省からGillian Eggleston博士を招聘し、同博士の専門分野であるサトウキビの品質劣化(Cane deterioration)について学ぶ機会を得た。
サトウキビの品質劣化とは、収穫前後や原料出荷時、製糖工場の原料ヤード、あるいは工場内での製糖過程などあらゆる場面において、サトウキビに含まれるスクロースが分解されて他の物質へと変化し、原料の品質を劣化させる現象のことである。スクロースが分解されることで糖度が下がるだけでなく、生成された劣化成分が製糖の阻害要因となるため歩留まりが著しく低下する。海外のサトウキビ生産国では大きな問題として取り上げられ、盛んに研究されているテーマである。
日本では、刈り取り後の原料の糖度低下などについて多数報告がある一方で、工場での劣化成分の分析に関するデータはあまり見当たらず、国内での本分野に関する知見は比較的限られている。そこで、Eggleston博士のセミナーの内容を中心にサトウキビの品質劣化に関する重要な情報について取りまとめたのでここで紹介する。
(注)タイ最大の製糖企業であるミトポン社が1997年に設立した研究機関。
サトウキビの品質劣化とは、収穫前後や原料出荷時、製糖工場の原料ヤード、あるいは工場内での製糖過程などあらゆる場面において、サトウキビに含まれるスクロースが分解されて他の物質へと変化し、原料の品質を劣化させる現象のことである。スクロースが分解されることで糖度が下がるだけでなく、生成された劣化成分が製糖の阻害要因となるため歩留まりが著しく低下する。海外のサトウキビ生産国では大きな問題として取り上げられ、盛んに研究されているテーマである。
日本では、刈り取り後の原料の糖度低下などについて多数報告がある一方で、工場での劣化成分の分析に関するデータはあまり見当たらず、国内での本分野に関する知見は比較的限られている。そこで、Eggleston博士のセミナーの内容を中心にサトウキビの品質劣化に関する重要な情報について取りまとめたのでここで紹介する。
(注)タイ最大の製糖企業であるミトポン社が1997年に設立した研究機関。
1.劣化の種類
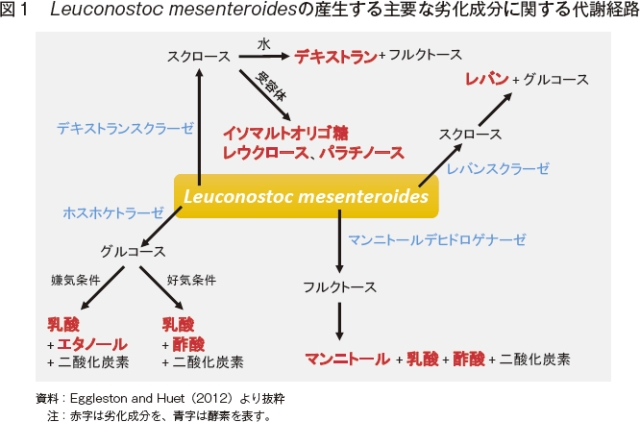
以下に表されるように、一般的にサトウキビの劣化は微生物、酵素およびその他の化学反応の3種類の過程によって引き起こされる。
・微生物(乳酸菌、デキストランスクラーゼ) スクロース + 水 → デキストラン + フルクトース
・酵素(インベルターゼ) スクロース + 水 → グルコース + フルクトース
・化学反応(酸分解) スクロース + 水 → グルコース + フルクトース
このうち酵母、細菌など微生物由来のものが全体の93.0%と最も割合が高く、次いでインベルターゼなどの酵素類由来が5.7%、1.3%のみがこれらによらない酸分解などの化学反応によるものである。劣化の大部分が微生物によることから、微生物由来の劣化をどう抑えるか、そして微生物の生成した劣化成分にどう対処するかが大きなポイントとなる。微生物に由来する劣化の中でもLeuconostoc属乳酸菌やLactobacillus属乳酸菌などの細菌によるものが主である。これら細菌は乳酸以外の物質を同時に産生するヘテロ乳酸発酵を行うため、その性質を生かし食品加工などの分野でも幅広く利用されている(図1)。主にサトウキビの枯死葉に存在し、25度以上の温暖湿潤な気候を好む。
また、割合は大きくないが、細菌以外にも乾燥地など特定の条件下では菌や酵母による劣化も生じる。Saccharomycesなどの酵母は工場内でしばしば見られ、特に嫌気条件下でスクロースをエタノールおよび二酸化炭素へ分解する働きを持つ。
・微生物(乳酸菌、デキストランスクラーゼ) スクロース + 水 → デキストラン + フルクトース
・酵素(インベルターゼ) スクロース + 水 → グルコース + フルクトース
・化学反応(酸分解) スクロース + 水 → グルコース + フルクトース
このうち酵母、細菌など微生物由来のものが全体の93.0%と最も割合が高く、次いでインベルターゼなどの酵素類由来が5.7%、1.3%のみがこれらによらない酸分解などの化学反応によるものである。劣化の大部分が微生物によることから、微生物由来の劣化をどう抑えるか、そして微生物の生成した劣化成分にどう対処するかが大きなポイントとなる。微生物に由来する劣化の中でもLeuconostoc属乳酸菌やLactobacillus属乳酸菌などの細菌によるものが主である。これら細菌は乳酸以外の物質を同時に産生するヘテロ乳酸発酵を行うため、その性質を生かし食品加工などの分野でも幅広く利用されている(図1)。主にサトウキビの枯死葉に存在し、25度以上の温暖湿潤な気候を好む。
また、割合は大きくないが、細菌以外にも乾燥地など特定の条件下では菌や酵母による劣化も生じる。Saccharomycesなどの酵母は工場内でしばしば見られ、特に嫌気条件下でスクロースをエタノールおよび二酸化炭素へ分解する働きを持つ。
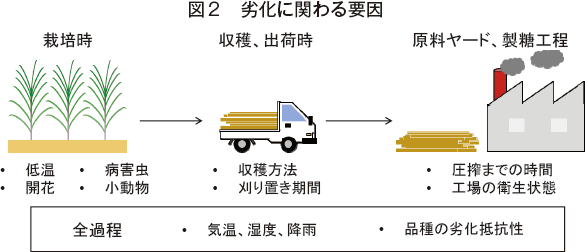
2.劣化に関わる要因
(1)低温
世界のサトウキビ生産国のおおよそ25%で、サトウキビへの低温害が報告されている。気温の低下に伴い芽子が壊死したり、茎に亀裂が生じたりするが、このように各器官が損傷を受けると微生物の侵入を受けやすくなる。被害の程度は、温度と低温にさらされた期間に影響されるだけでなく、その後の気候が温暖かつ湿潤であると微生物の増殖に適した条件であることからより甚大となる。
Eggleston博士の居住するルイジアナ州(米国)でも冬季には低温害が起こるため、サトウキビの栽培期間は7カ月、圧搾期間は3カ月に限られるという。低温害がひどく、原料の劣化が激しいときには、最悪の場合、工場の操業が停止することもある。
日本の主産地の中では、種子島においてサトウキビの品質劣化が深刻な問題となっている。種子島では、降霜前の収穫が推奨されていたり、劣化原料は正常原料と合わせて出荷したりといった対策が行われている。また、品質取引でサンプルを細裂する際に異臭や変色のある原料は正常原料と異なる方法で糖度の測定が行われる。
(2)開花
収穫が遅れると、開花により糖度が低下することがあるため、適期に収穫を行うことが重要である。また、開花に伴う糖度の低下程度は品種によって大きく異なることから、状況に応じて適切な品種を選択する。
一般的に開花は品質劣化を招く負の要因とされているが、開花は茎の熟度とも密接に関係し糖の蓄積した熟茎に生じるため、開花茎の方が高糖度であるといったデータも示されている。長期的な観察が必要になることからも、実験的にそれを証明するのは容易ではない。また、開花によって糖度は低下しても収量が増加する場合もあるので開花による品質の劣化が必ずしも産糖量の低下を指すわけではない。
(3)収穫前の火入れ
南北大東島を中心に初めて導入されたハーベスタは、バーンハーベスト(梢頭部や葉身などのトラッシュをあらかじめ焼却してから収穫する方法)に対応したタイプであったため、当時は収穫前に火入れを行っていたが現在日本では見られない。しかしながら、世界では依然として主流な収穫方法であり、タイでも直近10年の平均では60%以上の原料がバーンハーベストによって収穫されている。
前述したように劣化の主要因であるLeuconostoc属乳酸菌は、主にサトウキビの枯葉に存在するため、バーンハーベストは劣化を抑える効率的な収穫方法だと思われるかもしれないが、焼却された茎は細菌、菌の侵入を受けやすくなるため、結果としてグリーンハーベスト(火入れを行わない収穫方法)原料より劣化は早く進行する。
(4)収穫茎の長さ
手刈りによる全茎原料と比較し、ハーベスタによって細かく切断された原料は、切り口が多いため微生物の侵入を受けやすく、劣化の進行が早まる。近年、国内でも機械収穫率が高まり、平成27年産サトウキビでは鹿児島県のサトウキビ収穫面積の88%で、沖縄県では67%で機械収穫が実施されている。台風などの影響により倒伏、湾曲した茎が多い日本では細断式ハーベスタが主流であり、また今後、機械収穫率がさらに上昇すると予想されることからも、最も重要な要因と言えるだろう。
火入れの有無および収穫茎の長さによって収穫方法を劣化程度の早い順に並べると、(1)バーンハーベスト・細断原料(2)グリーンハーベスト・細断原料(3)バーンハーベスト・全茎原料(4)グリーンハーベスト・全茎原料−の順となる。
(5)刈り置き、圧搾までの期間
Leuconostoc属乳酸菌を人為的に原料茎に接種した実験では、細菌の増殖は接種10〜15時間後に急激に高まり、それに伴って劣化成分が著しく増加することが報告されている。細菌が感染するまでの時間も考慮して、全茎原料は刈り取り後24時間以内の圧搾が推奨されているが、機械収穫された細断原料は切り口が多く、特に高温多湿条件下では劣化が著しく早まるため、状況に合わせて6〜14時間以内に圧搾するのが望ましい。
(6)その他
上記以外にも、病害虫や野ネズミなどの小動物によって生じた傷口から微生物が感染することでも当然ながら劣化が進行する。工場内が不衛生で、微生物が繁殖しやすい条件では劣化が早まることから、工場の衛生状態にも劣化は左右される。また、気温や湿度、降雨といった気象条件や品種の劣化に対する抵抗性などは全過程で影響を与え得る要因である(図2)。
世界のサトウキビ生産国のおおよそ25%で、サトウキビへの低温害が報告されている。気温の低下に伴い芽子が壊死したり、茎に亀裂が生じたりするが、このように各器官が損傷を受けると微生物の侵入を受けやすくなる。被害の程度は、温度と低温にさらされた期間に影響されるだけでなく、その後の気候が温暖かつ湿潤であると微生物の増殖に適した条件であることからより甚大となる。
Eggleston博士の居住するルイジアナ州(米国)でも冬季には低温害が起こるため、サトウキビの栽培期間は7カ月、圧搾期間は3カ月に限られるという。低温害がひどく、原料の劣化が激しいときには、最悪の場合、工場の操業が停止することもある。
日本の主産地の中では、種子島においてサトウキビの品質劣化が深刻な問題となっている。種子島では、降霜前の収穫が推奨されていたり、劣化原料は正常原料と合わせて出荷したりといった対策が行われている。また、品質取引でサンプルを細裂する際に異臭や変色のある原料は正常原料と異なる方法で糖度の測定が行われる。
(2)開花
収穫が遅れると、開花により糖度が低下することがあるため、適期に収穫を行うことが重要である。また、開花に伴う糖度の低下程度は品種によって大きく異なることから、状況に応じて適切な品種を選択する。
一般的に開花は品質劣化を招く負の要因とされているが、開花は茎の熟度とも密接に関係し糖の蓄積した熟茎に生じるため、開花茎の方が高糖度であるといったデータも示されている。長期的な観察が必要になることからも、実験的にそれを証明するのは容易ではない。また、開花によって糖度は低下しても収量が増加する場合もあるので開花による品質の劣化が必ずしも産糖量の低下を指すわけではない。
(3)収穫前の火入れ
南北大東島を中心に初めて導入されたハーベスタは、バーンハーベスト(梢頭部や葉身などのトラッシュをあらかじめ焼却してから収穫する方法)に対応したタイプであったため、当時は収穫前に火入れを行っていたが現在日本では見られない。しかしながら、世界では依然として主流な収穫方法であり、タイでも直近10年の平均では60%以上の原料がバーンハーベストによって収穫されている。
前述したように劣化の主要因であるLeuconostoc属乳酸菌は、主にサトウキビの枯葉に存在するため、バーンハーベストは劣化を抑える効率的な収穫方法だと思われるかもしれないが、焼却された茎は細菌、菌の侵入を受けやすくなるため、結果としてグリーンハーベスト(火入れを行わない収穫方法)原料より劣化は早く進行する。
(4)収穫茎の長さ
手刈りによる全茎原料と比較し、ハーベスタによって細かく切断された原料は、切り口が多いため微生物の侵入を受けやすく、劣化の進行が早まる。近年、国内でも機械収穫率が高まり、平成27年産サトウキビでは鹿児島県のサトウキビ収穫面積の88%で、沖縄県では67%で機械収穫が実施されている。台風などの影響により倒伏、湾曲した茎が多い日本では細断式ハーベスタが主流であり、また今後、機械収穫率がさらに上昇すると予想されることからも、最も重要な要因と言えるだろう。
火入れの有無および収穫茎の長さによって収穫方法を劣化程度の早い順に並べると、(1)バーンハーベスト・細断原料(2)グリーンハーベスト・細断原料(3)バーンハーベスト・全茎原料(4)グリーンハーベスト・全茎原料−の順となる。
(5)刈り置き、圧搾までの期間
Leuconostoc属乳酸菌を人為的に原料茎に接種した実験では、細菌の増殖は接種10〜15時間後に急激に高まり、それに伴って劣化成分が著しく増加することが報告されている。細菌が感染するまでの時間も考慮して、全茎原料は刈り取り後24時間以内の圧搾が推奨されているが、機械収穫された細断原料は切り口が多く、特に高温多湿条件下では劣化が著しく早まるため、状況に合わせて6〜14時間以内に圧搾するのが望ましい。
(6)その他
上記以外にも、病害虫や野ネズミなどの小動物によって生じた傷口から微生物が感染することでも当然ながら劣化が進行する。工場内が不衛生で、微生物が繁殖しやすい条件では劣化が早まることから、工場の衛生状態にも劣化は左右される。また、気温や湿度、降雨といった気象条件や品種の劣化に対する抵抗性などは全過程で影響を与え得る要因である(図2)。
3.劣化原料に見られる成分
(1)デキストラン
グルコースがα-1,6グリコシド結合で連なった多糖類でLeuconostoc属乳酸菌のヘテロ乳酸発酵によって生成される。デキストランは、分子量によって低、中、高分子デキストランに分類されるが、製糖工程で引き起こされる問題の多くは高分子デキストランによるものである。従って、デキストランの量だけでなく、そのサイズによっても製糖効率は大きく左右される。
デキストランが増加すると、スライムの生成および粘性の増加、クラリファイヤー(注)での清浄化の阻害、効用缶での濃縮の阻害、結晶化の阻害、結晶サイズの変化、遠心分離の阻害、糖蜜中の糖のロスの増加など、ほぼ全ての工程で負の影響を与える。また、デキストラン存在下では旋光糖度計で測定したPol値が過大評価される傾向がある。原料糖中のデキストラン含量はBrixベースで2000〜4000ppmに達することもある。
(注)遠心分離器の一種で、静澄液と固形分とに分離する機械。
(2)マンニトール
糖アルコールの一種。デキストランと同じくLeuconostoc属乳酸菌によってつくられ、シラップや白下(注)などに多く含まれる。非常に安定した物質であるため、工程内では分解されない。多量に存在すると熱伝導率を低下させることから、効用缶で水分の蒸発を妨げたり、結晶化を阻害したりする。また、生成されたスクロースの結晶が集塊状化したり、マンニトール自体が針状の結晶を生成したりすることで原料糖の品質を低下させる。原料糖中のマンニトール含量はBrixベースで2000ppmにも達する。
ブラジルのエタノール工場では、生産効率の阻害要因として圧搾液や糖蜜中のマンニトールの分析を行ったり、米国やアルゼンチンでは各品種の劣化抵抗性の評価にマンニトールが用いられたりしている。また、同じ糖料作物であるてん菜では低温害による劣化程度の基準としてマンニトールが利用されるようになったことから、サトウキビでも同様にマンニトールを劣化の指標とする動きもみられる。
(注)砂糖の結晶と糖蜜が混合した状態のもの。
(3)有機酸
劣化の進行に伴い、有機酸含量、特にLeuconostoc属乳酸菌の主要な代謝産物である乳酸含量は著しく増加する。有機酸含量の増加に伴い、pHが低下するため、清浄化の際により多くの石灰が必要になる。また、特に酢酸含量が高い場合、酵母の働きが妨げられ、エタノールの生産効率が低下するため、海外のエタノール工場で問題となっている。
(4)エタノール
特にバーンハーベスト・全茎原料に多く含まれる。発酵によって酵母がスクロースを分解することで生成されるが、それ以外にもLeuconostoc属乳酸菌が乳酸を生成する際、同時にエタノールを生じることが知られている。ただし、これは炭素源にグルコースが用いられた場合に限られる。Brixベースで含量が1000 ppm増すごとに2〜3%の糖のロスが生じる。
(5)オリゴ糖
酵素反応および酸分解から得られるケストース、ニストース、ケストペンタオースなどのフラクトオリゴ糖やLeuconostoc属乳酸菌の持つデキストランスクラーゼの反応で二次産物として生成されるイソマルトトリオース、イソマルトテトラオース、レウクロース、パラチノースなどがある。劣化が始まる前にも、葉身や梢頭部などに含まれ、製糖時にはスクロースの結晶構造を変化させ、原料糖の品質を悪化させる。オリゴ糖の総量は、デキストランより高くなることもあり、特にバーンハーベスト・細断原料の劣化の指標として有効であることが報告されている。
グルコースがα-1,6グリコシド結合で連なった多糖類でLeuconostoc属乳酸菌のヘテロ乳酸発酵によって生成される。デキストランは、分子量によって低、中、高分子デキストランに分類されるが、製糖工程で引き起こされる問題の多くは高分子デキストランによるものである。従って、デキストランの量だけでなく、そのサイズによっても製糖効率は大きく左右される。
デキストランが増加すると、スライムの生成および粘性の増加、クラリファイヤー(注)での清浄化の阻害、効用缶での濃縮の阻害、結晶化の阻害、結晶サイズの変化、遠心分離の阻害、糖蜜中の糖のロスの増加など、ほぼ全ての工程で負の影響を与える。また、デキストラン存在下では旋光糖度計で測定したPol値が過大評価される傾向がある。原料糖中のデキストラン含量はBrixベースで2000〜4000ppmに達することもある。
(注)遠心分離器の一種で、静澄液と固形分とに分離する機械。
(2)マンニトール
糖アルコールの一種。デキストランと同じくLeuconostoc属乳酸菌によってつくられ、シラップや白下(注)などに多く含まれる。非常に安定した物質であるため、工程内では分解されない。多量に存在すると熱伝導率を低下させることから、効用缶で水分の蒸発を妨げたり、結晶化を阻害したりする。また、生成されたスクロースの結晶が集塊状化したり、マンニトール自体が針状の結晶を生成したりすることで原料糖の品質を低下させる。原料糖中のマンニトール含量はBrixベースで2000ppmにも達する。
ブラジルのエタノール工場では、生産効率の阻害要因として圧搾液や糖蜜中のマンニトールの分析を行ったり、米国やアルゼンチンでは各品種の劣化抵抗性の評価にマンニトールが用いられたりしている。また、同じ糖料作物であるてん菜では低温害による劣化程度の基準としてマンニトールが利用されるようになったことから、サトウキビでも同様にマンニトールを劣化の指標とする動きもみられる。
(注)砂糖の結晶と糖蜜が混合した状態のもの。
(3)有機酸
劣化の進行に伴い、有機酸含量、特にLeuconostoc属乳酸菌の主要な代謝産物である乳酸含量は著しく増加する。有機酸含量の増加に伴い、pHが低下するため、清浄化の際により多くの石灰が必要になる。また、特に酢酸含量が高い場合、酵母の働きが妨げられ、エタノールの生産効率が低下するため、海外のエタノール工場で問題となっている。
(4)エタノール
特にバーンハーベスト・全茎原料に多く含まれる。発酵によって酵母がスクロースを分解することで生成されるが、それ以外にもLeuconostoc属乳酸菌が乳酸を生成する際、同時にエタノールを生じることが知られている。ただし、これは炭素源にグルコースが用いられた場合に限られる。Brixベースで含量が1000 ppm増すごとに2〜3%の糖のロスが生じる。
(5)オリゴ糖
酵素反応および酸分解から得られるケストース、ニストース、ケストペンタオースなどのフラクトオリゴ糖やLeuconostoc属乳酸菌の持つデキストランスクラーゼの反応で二次産物として生成されるイソマルトトリオース、イソマルトテトラオース、レウクロース、パラチノースなどがある。劣化が始まる前にも、葉身や梢頭部などに含まれ、製糖時にはスクロースの結晶構造を変化させ、原料糖の品質を悪化させる。オリゴ糖の総量は、デキストランより高くなることもあり、特にバーンハーベスト・細断原料の劣化の指標として有効であることが報告されている。
4.劣化成分の測定方法および原料の劣化程度の把握
劣化原料に対処するためには工場に搬入された原料の劣化程度を正確に把握する必要がある。前項で紹介したようにサトウキビには、さまざまな劣化成分が存在するが、ここではその中でも代表的なデキストランおよびマンニトールに着目したい。
(1)デキストラン
デキストランの測定方法には、オーデュボン砂糖協会の推奨するASI-II法や、抗原抗体反応法、そして現在最も一般的に用いられている濁度法(写真1)などがある。しかし、それぞれ(1)工程が複雑で分析に長時間を要する(2)高価なキット(1サンプル当たり約1000円)が必要(3)他の糖類も検出する恐れがあり結果の解釈が困難―といった問題がある。その他、デキストランが生成される際にグルコースのみが消費されるためグルコース/フルクトース比が低下することから、この比を用いて簡易的にデキストラン量を推定する方法もある。デキストランは劣化成分の中でも最も重要な成分の一つだが、正確かつ実用的な測定法は用いられていないのが現状である。現在、ルイジアナ州農務省では工場でも適用できる簡易法の考案を試みている。
(1)デキストラン
デキストランの測定方法には、オーデュボン砂糖協会の推奨するASI-II法や、抗原抗体反応法、そして現在最も一般的に用いられている濁度法(写真1)などがある。しかし、それぞれ(1)工程が複雑で分析に長時間を要する(2)高価なキット(1サンプル当たり約1000円)が必要(3)他の糖類も検出する恐れがあり結果の解釈が困難―といった問題がある。その他、デキストランが生成される際にグルコースのみが消費されるためグルコース/フルクトース比が低下することから、この比を用いて簡易的にデキストラン量を推定する方法もある。デキストランは劣化成分の中でも最も重要な成分の一つだが、正確かつ実用的な測定法は用いられていないのが現状である。現在、ルイジアナ州農務省では工場でも適用できる簡易法の考案を試みている。

(2)マンニトール
Eggleston博士は、酵素法により迅速かつ簡便にマンニトールを測定する方法を考案した。この方法は2010年に国際砂糖分析統一委員会(ICUMSA)の公式法として登録された。1サンプルの測定時間は7分以下、コストは60円程度だが、他の糖類の存在にかかわらず信頼性の高い分析結果が得られるため、現場利用も十分可能である(測定法の詳細はEggleston and Harper〈2006〉を参照)。また、マンニトールだけでなくオリゴ糖やエタノールの同時測定が可能なイオンクロマトグラフィー法があるが、高価な機械や専門知識、高度な技術が必要となるため現場での利用には適さない。
(3)劣化程度の指標
劣化を引き起こす最大の原因はLeuconostoc属乳酸菌であることから、デキストランおよびマンニトールの両方を測定し、劣化程度の目安とするのが理想だが、上述したように現在の測定法でデキストランを正確に分析するのは難しい。マンニトールが存在すれば必ずデキストランも存在し、両者の間には高い正の相関が認められることから、Eggleston博士はマンニトールを劣化程度の指標とするのが好ましいと結論づけている。また、圧搾汁のpHとデキストラン生成量の間には高い負の相関関係が確認されていることから、サトウキビの劣化が疑われる場合には簡易法として圧搾汁のpHを測定する方法がある(写真2)。pHが5.3以下である場合、原料が劣化していると考えてよい。
Eggleston博士は、酵素法により迅速かつ簡便にマンニトールを測定する方法を考案した。この方法は2010年に国際砂糖分析統一委員会(ICUMSA)の公式法として登録された。1サンプルの測定時間は7分以下、コストは60円程度だが、他の糖類の存在にかかわらず信頼性の高い分析結果が得られるため、現場利用も十分可能である(測定法の詳細はEggleston and Harper〈2006〉を参照)。また、マンニトールだけでなくオリゴ糖やエタノールの同時測定が可能なイオンクロマトグラフィー法があるが、高価な機械や専門知識、高度な技術が必要となるため現場での利用には適さない。
(3)劣化程度の指標
劣化を引き起こす最大の原因はLeuconostoc属乳酸菌であることから、デキストランおよびマンニトールの両方を測定し、劣化程度の目安とするのが理想だが、上述したように現在の測定法でデキストランを正確に分析するのは難しい。マンニトールが存在すれば必ずデキストランも存在し、両者の間には高い正の相関が認められることから、Eggleston博士はマンニトールを劣化程度の指標とするのが好ましいと結論づけている。また、圧搾汁のpHとデキストラン生成量の間には高い負の相関関係が確認されていることから、サトウキビの劣化が疑われる場合には簡易法として圧搾汁のpHを測定する方法がある(写真2)。pHが5.3以下である場合、原料が劣化していると考えてよい。

5.劣化の防止策および劣化原料への対策
(1)収穫、出荷時の対策
枯死葉にはLeuconostoc属乳酸菌が生息していることから、トラッシュの減少はトラッシュ率を低下させるだけでなく劣化の防止にもつながる。そのため、手刈り原料には特別に手当を付与するといった措置を講ずるのも良い。刈り取り後は圃(ほ)場(じょう)に原料を長時間放置せず速やかに工場へ搬入できるよう計画的に収穫を行う。全茎原料は、刈り取り後24時間以内、細断原料は刈り取り後6〜14時間以内の圧搾が推奨されている。
(2)製糖時の対策
劣化原料は、正常原料と混ぜて製糖を行う。pH5.0以下の原料は、特に劣化程度が著しいと考えられるので場合によっては、製糖工程から除くなどの対処を行う必要がある。また、スクロースは、圧搾汁のpHが8.3で安定し、それ以下では酸分解する可能性があるため、pHを適切な値になるよう調整する。調整に際し、多量に石灰を投入する場合、炭酸ナトリウムの代用も可能である。遠心分離の過程で白下の回収効率を上げるため、結晶缶への給水量を増やす。糖以外の不純物をなるべく早い段階で取り除くことと、除いた不純物が再び工程へと戻ることがないよう心掛ける。
(3)デキストラナーゼの利用
デキストラナーゼは、ランダムにデキストラン内部のα-1,6グリコシド結合を切断し加水分解することで、高分子デキストランを低分子デキストランへと変化させる酵素である。Chaetomium gracile、C. erraticum、Penicillium(米国では使用禁止)などが用いられる。豪州を中心に1970年代から製糖に利用されてきたが、酵素の種類や投入量、投入するタイミングが適切であったかなどの評価は十分に行われてこなかった。
その背景として、デキストラナーゼ活性に異なる単位や測定方法が用いられ各酵素の評価が難しい、他の酵素と比較し市場が小規模で価格や酵素活性の変動が著しいといった問題がある。Eggleston博士はデキストラナーゼを酵素活性により濃縮タイプ(25000〜58000 U/mL)と非濃縮タイプ(25000 U/mL以下)に分類しており、平均すると濃縮タイプは非濃縮タイプの約3倍の価格だがコストパフォーマンスは高い。
デキストラナーゼ活性にはさまざまな要因が関与しており、至適温度は45〜50度、至適pHは5.0〜6.0で、Brixが25〜30%までは比較的活性は安定しているがそれ以上になると水分の割合が減るため活性が低下する。そのため、工場で利用する際には50度を超えない範囲で濃縮タイプをジュースタンクに投入するのが最も効果的である。後述する薬剤の投与によるデキストラナーゼ活性への影響は認められていないことから、薬剤との併用も可能である。値段も安くはないのでデキストラナーゼは、必ずデキストランが一定量(デキストラン1000 ppmまたはマンニトール300 ppm)以上存在するときに使用する。また、プルナラーゼはα-1,6グリコシド結合を切断する枝切り酵素で、何らかの理由でデキストラナーゼが利用できない場合に代用できる。
(4)微生物への薬剤の使用
工程内で微生物の繁殖を妨げ、工場内を清潔に保つと同時に糖の損失を抑えるために、薬剤を使用する方法がある。ルイジアナ州の工場で使用されている薬剤には、グラム陽性菌の生育を抑制するフムロンやカルバメートなどの静菌剤と多様な微生物を死に至らしめる次亜塩素酸ナトリウムなどの殺菌剤がある。しかし、カルバメートには毒性があったり、次亜塩素酸ナトリウムは工場内の設備を腐食する作用があったりなど薬剤の使用はデメリットを伴うこともある。ルイジアナ州では1工場当たり毎年約1500万円分の薬剤が使用されているがこれらの薬剤が効果的に機能しているかどうか不明であった。
そこで、工程内のさまざまな箇所で得られたサンプルを対象に薬剤を使用した結果、圧搾直後の液では効果は得られなかったが、ジュースヒーターまたはクラリファイヤー通過後に加熱処理した液では微生物の増殖が著しく抑制された。このように薬剤の投与は加熱(72度)後の圧搾液に対してのみ大きな効果が認められる。しかし、Eggleston博士は圧搾液への薬剤の使用は費用対効果が低いため、原料ヤードもしくは工場内の静菌、殺菌に利用することを推奨している。また、試験段階ではあるが第四級アンモニウム薬剤の使用も試みられている。
枯死葉にはLeuconostoc属乳酸菌が生息していることから、トラッシュの減少はトラッシュ率を低下させるだけでなく劣化の防止にもつながる。そのため、手刈り原料には特別に手当を付与するといった措置を講ずるのも良い。刈り取り後は圃(ほ)場(じょう)に原料を長時間放置せず速やかに工場へ搬入できるよう計画的に収穫を行う。全茎原料は、刈り取り後24時間以内、細断原料は刈り取り後6〜14時間以内の圧搾が推奨されている。
(2)製糖時の対策
劣化原料は、正常原料と混ぜて製糖を行う。pH5.0以下の原料は、特に劣化程度が著しいと考えられるので場合によっては、製糖工程から除くなどの対処を行う必要がある。また、スクロースは、圧搾汁のpHが8.3で安定し、それ以下では酸分解する可能性があるため、pHを適切な値になるよう調整する。調整に際し、多量に石灰を投入する場合、炭酸ナトリウムの代用も可能である。遠心分離の過程で白下の回収効率を上げるため、結晶缶への給水量を増やす。糖以外の不純物をなるべく早い段階で取り除くことと、除いた不純物が再び工程へと戻ることがないよう心掛ける。
(3)デキストラナーゼの利用
デキストラナーゼは、ランダムにデキストラン内部のα-1,6グリコシド結合を切断し加水分解することで、高分子デキストランを低分子デキストランへと変化させる酵素である。Chaetomium gracile、C. erraticum、Penicillium(米国では使用禁止)などが用いられる。豪州を中心に1970年代から製糖に利用されてきたが、酵素の種類や投入量、投入するタイミングが適切であったかなどの評価は十分に行われてこなかった。
その背景として、デキストラナーゼ活性に異なる単位や測定方法が用いられ各酵素の評価が難しい、他の酵素と比較し市場が小規模で価格や酵素活性の変動が著しいといった問題がある。Eggleston博士はデキストラナーゼを酵素活性により濃縮タイプ(25000〜58000 U/mL)と非濃縮タイプ(25000 U/mL以下)に分類しており、平均すると濃縮タイプは非濃縮タイプの約3倍の価格だがコストパフォーマンスは高い。
デキストラナーゼ活性にはさまざまな要因が関与しており、至適温度は45〜50度、至適pHは5.0〜6.0で、Brixが25〜30%までは比較的活性は安定しているがそれ以上になると水分の割合が減るため活性が低下する。そのため、工場で利用する際には50度を超えない範囲で濃縮タイプをジュースタンクに投入するのが最も効果的である。後述する薬剤の投与によるデキストラナーゼ活性への影響は認められていないことから、薬剤との併用も可能である。値段も安くはないのでデキストラナーゼは、必ずデキストランが一定量(デキストラン1000 ppmまたはマンニトール300 ppm)以上存在するときに使用する。また、プルナラーゼはα-1,6グリコシド結合を切断する枝切り酵素で、何らかの理由でデキストラナーゼが利用できない場合に代用できる。
(4)微生物への薬剤の使用
工程内で微生物の繁殖を妨げ、工場内を清潔に保つと同時に糖の損失を抑えるために、薬剤を使用する方法がある。ルイジアナ州の工場で使用されている薬剤には、グラム陽性菌の生育を抑制するフムロンやカルバメートなどの静菌剤と多様な微生物を死に至らしめる次亜塩素酸ナトリウムなどの殺菌剤がある。しかし、カルバメートには毒性があったり、次亜塩素酸ナトリウムは工場内の設備を腐食する作用があったりなど薬剤の使用はデメリットを伴うこともある。ルイジアナ州では1工場当たり毎年約1500万円分の薬剤が使用されているがこれらの薬剤が効果的に機能しているかどうか不明であった。
そこで、工程内のさまざまな箇所で得られたサンプルを対象に薬剤を使用した結果、圧搾直後の液では効果は得られなかったが、ジュースヒーターまたはクラリファイヤー通過後に加熱処理した液では微生物の増殖が著しく抑制された。このように薬剤の投与は加熱(72度)後の圧搾液に対してのみ大きな効果が認められる。しかし、Eggleston博士は圧搾液への薬剤の使用は費用対効果が低いため、原料ヤードもしくは工場内の静菌、殺菌に利用することを推奨している。また、試験段階ではあるが第四級アンモニウム薬剤の使用も試みられている。
6.もう一つの製糖阻害要因〜でん粉
(1)でん粉とは
デキストランやマンニトールといった劣化成分がLeuconostoc属乳酸菌などによって生産されるのに対し、でん粉は、立毛状態のサトウキビ内部の主に生葉で生成される。そのため、劣化成分とは異なるが歩留まりに影響を与える重要な要因であるのでこの場で紹介したい。
梢頭部や葉などのトラッシュに多く含まれる傾向があり、圧搾汁中のでん粉含量は6000ppmに達することもある。でん粉が与える粘性への影響はデキストランよりも大きく、低温時には高分子ゲルを生成する。サトウキビに含まれるでん粉には可溶性および不溶性が存在し、一般的な圧搾液では可溶性でん粉の割合の方がやや高い。どちらも製糖の阻害要因であり、含量が高まると原料の粘性が増し糖の回収率が低下する。また、不溶性でん粉含量が高いとでん粉分解酵素であるアミラーゼの活性が低下する。製糖工程で可溶化しなかった不溶性でん粉は、原料糖中に残存するため、結果として原料糖の品質を大きく低下させる。原料糖に残った不溶性でん粉は、精糖時の清浄化およびろ過を妨げる。
(2)でん粉を含む原料への対策(α-アミラーゼの利用)
α-アミラーゼはアミロースとアミロペクチンのα-1,4グリコシド結合を切断する働きを持ち、でん粉を低分子化し、短鎖の糖へと分解する酵素である。デキストラナーゼと比較して、安価で入手しやすく、研究も盛んに行われている。多くの産業で利用されている一方で、製糖業界での普及はあまり進んでいない。比較的熱に対して安定で、中耐温性(〜85度)と高耐温性アミラーゼ(〜105度)に分類される。効用缶の最終段階で投入するのが最も効率的だが、圧搾汁中のでん粉含量が非常に高いとき、もしくは不溶性でん粉含量の割合が高いときにはクラリファイヤーへの同時投与も推奨されている。しかしながら、でん粉含量に見合わない多量のアミラーゼを投入すると、後にプリンやBBQソースなど砂糖やシラップを使用した製品中でアミラーゼが活性を取り戻し、でん粉の分解を行う、いわゆるキャリーオーバーという現象が見られることがある。特にキャリーオーバーは、熱に対して安定な高耐温性アミラーゼを投与したときに起こる場合が多いので、工場では中耐温性アミラーゼを必要量のみ使用するのが好ましい。
ブラジルのProzyn社の新酵素「StarMax Zero」は、クラリファイヤー中で60分間活性が持続するが、その後の工程では不活性となりキャリーオーバーが生じないため、近年注目されている。StarMax Zeroは非常に活性が高く、投与量を従来のアミラーゼの4分の1〜6分の1程度に抑えることもできるという。他にも、粉末活性炭を用いて残存したアミラーゼを除去する試みなどが行われている。
(3)でん粉の測定方法
これまでのICUMSAの公式測定法では、でん粉の可溶化、ろ過に煮沸および遠心分離が必要で、前処理に10分を要していた。近年、Eggleston博士は電子レンジによる加熱および超音波処理によって、前処理を6分に短縮した新たな測定法「米国農務省リサーチ(USDA research)法」を考案した。分析時間の短縮だけでなく、不溶性でん粉含量の高いサンプルも分析できることから、圧搾液、シラップ、原料糖、糖蜜、バガスなどさまざまなサンプルに適用可能である。特筆すべきは、従来法が総でん粉含量のみを対象とするのに対し、米国農務省リサーチ法は、未処理サンプルを同時に分析することで可溶性でん粉と不溶性でん粉含量の画分が可能な点である(詳しくはCole et al〈2016〉を参照)。
さらに、Eggleston博士は工場でも適用可能な簡易測定法(USDA factory/refinery method)の検討も行っている。この方法では前処理に必要な機械は電子レンジのみで、処理時間は2分、コストも1サンプル5円以下にまで抑えられている。米国農務省リサーチ法と比較しても回収率は90%程度と結果も良好であり、今後現場での利用に期待がかかる。
デキストランやマンニトールといった劣化成分がLeuconostoc属乳酸菌などによって生産されるのに対し、でん粉は、立毛状態のサトウキビ内部の主に生葉で生成される。そのため、劣化成分とは異なるが歩留まりに影響を与える重要な要因であるのでこの場で紹介したい。
梢頭部や葉などのトラッシュに多く含まれる傾向があり、圧搾汁中のでん粉含量は6000ppmに達することもある。でん粉が与える粘性への影響はデキストランよりも大きく、低温時には高分子ゲルを生成する。サトウキビに含まれるでん粉には可溶性および不溶性が存在し、一般的な圧搾液では可溶性でん粉の割合の方がやや高い。どちらも製糖の阻害要因であり、含量が高まると原料の粘性が増し糖の回収率が低下する。また、不溶性でん粉含量が高いとでん粉分解酵素であるアミラーゼの活性が低下する。製糖工程で可溶化しなかった不溶性でん粉は、原料糖中に残存するため、結果として原料糖の品質を大きく低下させる。原料糖に残った不溶性でん粉は、精糖時の清浄化およびろ過を妨げる。
(2)でん粉を含む原料への対策(α-アミラーゼの利用)
α-アミラーゼはアミロースとアミロペクチンのα-1,4グリコシド結合を切断する働きを持ち、でん粉を低分子化し、短鎖の糖へと分解する酵素である。デキストラナーゼと比較して、安価で入手しやすく、研究も盛んに行われている。多くの産業で利用されている一方で、製糖業界での普及はあまり進んでいない。比較的熱に対して安定で、中耐温性(〜85度)と高耐温性アミラーゼ(〜105度)に分類される。効用缶の最終段階で投入するのが最も効率的だが、圧搾汁中のでん粉含量が非常に高いとき、もしくは不溶性でん粉含量の割合が高いときにはクラリファイヤーへの同時投与も推奨されている。しかしながら、でん粉含量に見合わない多量のアミラーゼを投入すると、後にプリンやBBQソースなど砂糖やシラップを使用した製品中でアミラーゼが活性を取り戻し、でん粉の分解を行う、いわゆるキャリーオーバーという現象が見られることがある。特にキャリーオーバーは、熱に対して安定な高耐温性アミラーゼを投与したときに起こる場合が多いので、工場では中耐温性アミラーゼを必要量のみ使用するのが好ましい。
ブラジルのProzyn社の新酵素「StarMax Zero」は、クラリファイヤー中で60分間活性が持続するが、その後の工程では不活性となりキャリーオーバーが生じないため、近年注目されている。StarMax Zeroは非常に活性が高く、投与量を従来のアミラーゼの4分の1〜6分の1程度に抑えることもできるという。他にも、粉末活性炭を用いて残存したアミラーゼを除去する試みなどが行われている。
(3)でん粉の測定方法
これまでのICUMSAの公式測定法では、でん粉の可溶化、ろ過に煮沸および遠心分離が必要で、前処理に10分を要していた。近年、Eggleston博士は電子レンジによる加熱および超音波処理によって、前処理を6分に短縮した新たな測定法「米国農務省リサーチ(USDA research)法」を考案した。分析時間の短縮だけでなく、不溶性でん粉含量の高いサンプルも分析できることから、圧搾液、シラップ、原料糖、糖蜜、バガスなどさまざまなサンプルに適用可能である。特筆すべきは、従来法が総でん粉含量のみを対象とするのに対し、米国農務省リサーチ法は、未処理サンプルを同時に分析することで可溶性でん粉と不溶性でん粉含量の画分が可能な点である(詳しくはCole et al〈2016〉を参照)。
さらに、Eggleston博士は工場でも適用可能な簡易測定法(USDA factory/refinery method)の検討も行っている。この方法では前処理に必要な機械は電子レンジのみで、処理時間は2分、コストも1サンプル5円以下にまで抑えられている。米国農務省リサーチ法と比較しても回収率は90%程度と結果も良好であり、今後現場での利用に期待がかかる。
おわりに
冒頭でも述べたように、主に日本では収穫後いかに劣化を起こさせないかということに重点が置かれ、実際に工場に運ばれてくる原料の劣化がどの程度進行しているのかということについてはほとんど調べられてこなかった。しかし、品質劣化を正しく評価し、それに応じた対策を講ずることができれば、同じ原料からより多くの糖を回収することができる。サトウキビ生産量自体の大幅な増加を見込むのが難しい今、単収や糖度の改善だけではなく、このような視点から砂糖増産を図ることも重要かもしれない。
米国だけでなく、ブラジル、タイ、豪州など大規模に生産を行っている国では、劣化原料に適切に対処することで積極的に歩留まりの向上に取り組んでいる。これらの、いわゆるサトウキビ大国と比べ、国内の製糖工場は小規模であることから、日本で同様の対策を行うことはコストやシステムの都合上難しい部分もあるだろう。しかしながら、本稿で紹介したように各成分の測定法はより簡便化され、現場への導入も決して不可能ではない。
また、デキストラナーゼの投与など工場の規模によらず実施できる対策も存在する。まずは試験的に劣化成分の測定を行い、海外との比較から国内原料の劣化程度を把握し、日本の工場に適した対応を検討する価値は十分にある。さらに国外では近赤外分光法を用いて劣化成分を測定する試みも行われている。日本の品質評価にも同システムが利用されているため、甘しゃ糖度に加えて劣化成分も同時に測定できればトラック1台ごとに劣化程度を把握することも可能である。今後の研究成果に期待したい。本稿が品質劣化の重要性の認知、そして国内製糖業の発展の一助となれば幸いである。
最後に、セミナーやメールのやり取りを通して本稿の作成に協力してくださった米国ルイジアナ州農務省Gillian Eggleston博士に心より御礼申し上げます。
米国だけでなく、ブラジル、タイ、豪州など大規模に生産を行っている国では、劣化原料に適切に対処することで積極的に歩留まりの向上に取り組んでいる。これらの、いわゆるサトウキビ大国と比べ、国内の製糖工場は小規模であることから、日本で同様の対策を行うことはコストやシステムの都合上難しい部分もあるだろう。しかしながら、本稿で紹介したように各成分の測定法はより簡便化され、現場への導入も決して不可能ではない。
また、デキストラナーゼの投与など工場の規模によらず実施できる対策も存在する。まずは試験的に劣化成分の測定を行い、海外との比較から国内原料の劣化程度を把握し、日本の工場に適した対応を検討する価値は十分にある。さらに国外では近赤外分光法を用いて劣化成分を測定する試みも行われている。日本の品質評価にも同システムが利用されているため、甘しゃ糖度に加えて劣化成分も同時に測定できればトラック1台ごとに劣化程度を把握することも可能である。今後の研究成果に期待したい。本稿が品質劣化の重要性の認知、そして国内製糖業の発展の一助となれば幸いである。
最後に、セミナーやメールのやり取りを通して本稿の作成に協力してくださった米国ルイジアナ州農務省Gillian Eggleston博士に心より御礼申し上げます。
参考文献
1)Eggleston,G. and Harper,W.(2006)「Determination of sugarcane deterioration at the factory: Development of a rapid, easy and inexpensive enzymatic method to measure mannitol」『Food Chemistry 98』pp336-372.
2)Eggleston,G. and Huet,J. M.(2012) 「The measurement of mannitol in beet sugar factories to monitor deterioration and processing problems」 『Zuckerindustrie-Sugar Industry 137』 pp33-39.
3)Cole,M.,Eggleston,G.,Gilbert,A. and Chung,Y.J.(2016) 「Development of an analytical method to measure insoluble and soluble starch in sugarcane and sweet sorghum products」『Food Chemistry 190』pp50-59.
1)Eggleston,G. and Harper,W.(2006)「Determination of sugarcane deterioration at the factory: Development of a rapid, easy and inexpensive enzymatic method to measure mannitol」『Food Chemistry 98』pp336-372.
2)Eggleston,G. and Huet,J. M.(2012) 「The measurement of mannitol in beet sugar factories to monitor deterioration and processing problems」 『Zuckerindustrie-Sugar Industry 137』 pp33-39.
3)Cole,M.,Eggleston,G.,Gilbert,A. and Chung,Y.J.(2016) 「Development of an analytical method to measure insoluble and soluble starch in sugarcane and sweet sorghum products」『Food Chemistry 190』pp50-59.
このページに掲載されている情報の発信元
農畜産業振興機構 調査情報部 (担当:企画情報グル―プ)
Tel:03-3583-8678
農畜産業振興機構 調査情報部 (担当:企画情報グル―プ)
Tel:03-3583-8678